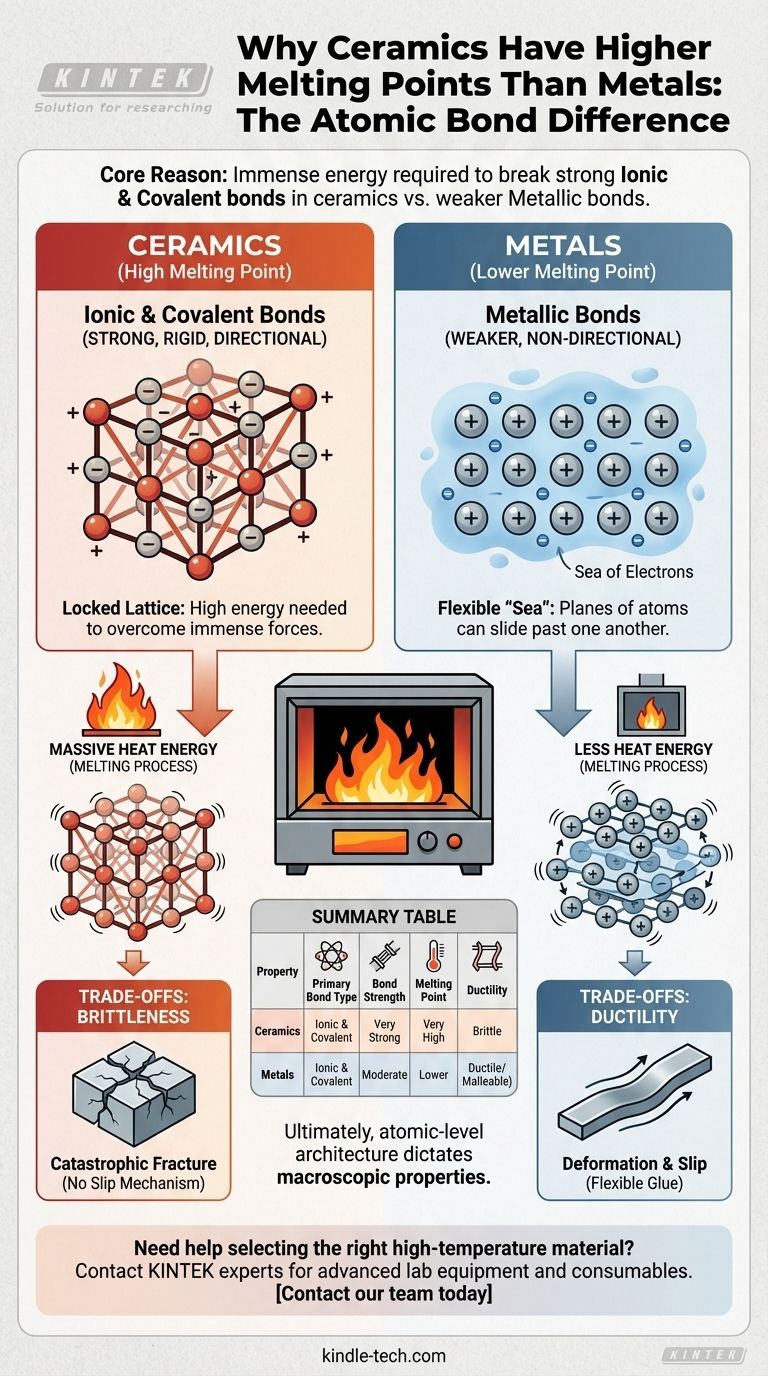
En esencia, la inmensa diferencia en la temperatura de fusión entre las cerámicas y la mayoría de los metales se reduce a la naturaleza fundamental de sus enlaces atómicos. Las cerámicas se mantienen unidas por enlaces iónicos y covalentes extremadamente fuertes, que requieren una enorme cantidad de energía para romperse, mientras que los metales se mantienen unidos por enlaces metálicos débiles y no direccionales.
El principio definitorio es simple: el punto de fusión de un material es una medida directa de la energía necesaria para romper los enlaces que mantienen unidos a sus átomos. Los potentes enlaces iónicos y covalentes en las cerámicas crean una estructura rígida y estable que exige mucha más energía térmica para desmantelarse que el "mar de electrones" flexible que define los enlaces metálicos.

La Diferencia Definitoria: El Enlace Atómico
Para comprender las propiedades térmicas, primero debemos entender cómo se conectan los átomos entre sí. El tipo y la fuerza de estas conexiones son los principales factores que dictan el punto de fusión de un material.
Enlaces Metálicos: Un "Mar" de Electrones
En los metales, los electrones externos de los átomos no están ligados a ningún átomo en particular. En cambio, forman un "mar" de electrones deslocalizado que fluye libremente alrededor de una red fija de iones metálicos positivos.
Esta disposición crea una fuerte fuerza cohesiva, pero los enlaces son no direccionales. Esto permite que los planos de átomos se deslicen unos sobre otros sin un fallo catastrófico, razón por la cual los metales son dúctiles y maleables.
Enlaces Iónicos: Una Atracción Poderosa
Muchas cerámicas se forman mediante enlaces iónicos, que ocurren entre iones cargados positivamente (cationes) e iones cargados negativamente (aniones). Un ejemplo clásico es un óxido metálico.
La poderosa atracción electrostática entre estas cargas opuestas crea enlaces muy fuertes, rígidos y direccionales. Esto fija los iones en una red cristalina altamente estable.
Enlaces Covalentes: El Par Compartido
Otras cerámicas, como el carburo de silicio, se definen por enlaces covalentes. Aquí, los átomos comparten electrones para formar pares de electrones estables, creando enlaces excepcionalmente fuertes y altamente direccionales.
Este tipo de enlace da como resultado algunos de los materiales más duros y resistentes al calor conocidos, ya que romper estos pares compartidos requiere una tremenda cantidad de energía.
Cerámicas: Una Combinación de Fuerza
Fundamentalmente, la mayoría de las cerámicas avanzadas exhiben una mezcla de carácter iónico y covalente. Esta combinación produce una estructura atómica con una energía de enlace excepcionalmente alta, creando un marco rígido que es increíblemente resistente a las vibraciones atómicas inducidas por el calor.
Cómo la Estructura Dicta la Estabilidad Térmica
El enlace determina la estructura atómica, y esa estructura determina cómo se comporta el material cuando se calienta.
Fusión: El Proceso de Romper una Red
La fusión es el proceso de suministrar suficiente energía térmica para permitir que los átomos o iones se liberen de sus posiciones fijas en la red cristalina. El calor es simplemente vibración atómica; cuanto mayor es la temperatura, más violentamente vibran los átomos.
Por Qué los Enlaces Más Fuertes Exigen Más Energía
Para romper la red rígida y direccionalmente fija de una cerámica, sus átomos deben vibrar con suficiente intensidad para superar las inmensas fuerzas iónicas y covalentes que los mantienen en su lugar. Esto requiere una temperatura muy alta.
En contraste, la naturaleza deslocalizada y no direccional de los enlaces metálicos permite que la red se altere con una energía térmica significativamente menor.
Comprender las Compensaciones
Esta alta estabilidad térmica en las cerámicas no se logra sin compromisos. La naturaleza del enlace que proporciona resistencia también introduce limitaciones significativas.
La Resistencia Tiene un Costo: Fragilidad
Los mismos enlaces fuertes y direccionales que le dan a las cerámicas su alto punto de fusión también las hacen frágiles. Cuando una cerámica se somete a tensión, no hay un mecanismo fácil para que los átomos se deslicen unos sobre otros.
En cambio, los enlaces rígidos se fracturan catastróficamente. Cualquier pequeña grieta concentra la tensión y se propaga a través del material con muy poca entrada de energía.
La Ventaja de los Metales: Ductilidad
El "mar de electrones" en los metales actúa como un pegamento flexible. Permite que los planos atómicos se deslicen y se deformen bajo tensión sin romper la cohesión general del material.
Esta propiedad, conocida como ductilidad, es una compensación directa por tener enlaces más débiles y, consecuentemente, puntos de fusión más bajos.
Tomar la Decisión Correcta para su Aplicación
Comprender estas diferencias fundamentales es fundamental para la selección de materiales en cualquier contexto de ingeniería.
- Si su enfoque principal es la integridad estructural a alta temperatura: Las cerámicas son la opción inequívoca debido a la excepcional estabilidad térmica que otorgan sus fuertes enlaces iónicos y covalentes.
- Si su enfoque principal es la tenacidad, la capacidad de conformación y la resistencia a la fractura: Los metales son la opción superior, ya que sus enlaces metálicos no direccionales permiten la deformación en lugar de la falla catastrófica.
- Si necesita un equilibrio de propiedades: Considere materiales avanzados como los compuestos cerámico-metálicos (cermets), diseñados para combinar la dureza de las cerámicas con la tenacidad de los metales.
En última instancia, las propiedades macroscópicas de un material son un reflejo directo de su arquitectura a nivel atómico.
Tabla Resumen:
| Propiedad | Cerámicas | Metales |
|---|---|---|
| Tipo de Enlace Principal | Iónico y Covalente | Metálico |
| Fuerza del Enlace | Muy Fuerte | Moderada |
| Punto de Fusión | Muy Alto | Más Bajo |
| Ductilidad | Frágil | Dúctil/Maleable |
¿Necesita ayuda para seleccionar el material de alta temperatura adecuado para su aplicación? En KINTEK, nos especializamos en proporcionar equipos de laboratorio avanzados y consumibles para pruebas de materiales e investigación. Ya sea que trabaje con cerámicas de alto punto de fusión o metales dúctiles, nuestros expertos pueden ayudarle a elegir la solución perfecta para las necesidades de su laboratorio. ¡Contacte a nuestro equipo hoy mismo para discutir cómo podemos apoyar su investigación y garantizar un rendimiento óptimo!
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuál es la nueva tecnología para las carillas? Descubra la revolución digital para una sonrisa perfecta
- ¿Qué tiene de especial el carburo de silicio? Desbloquee un rendimiento inigualable en condiciones extremas
- ¿La cerámica se rompe con el calor? El verdadero culpable es el choque térmico
- ¿Cuáles son las 4 clases principales de materiales cerámicos? Una guía de sus funciones y aplicaciones
- ¿Cuáles son las desventajas del carburo de tungsteno? Entendiendo la relación entre fragilidad y dureza
- ¿Por qué se utilizan las cerámicas para el revestimiento de hornos? Logre la máxima eficiencia y durabilidad
- ¿Por qué los pellets de Beta-Al2O3 se cubren con polvo durante la sinterización? Domina el control de la volatilidad para obtener mejores cerámicas
- ¿Qué determina la resistencia de las cerámicas? El sorprendente papel de los defectos microscópicos en la falla frágil



















