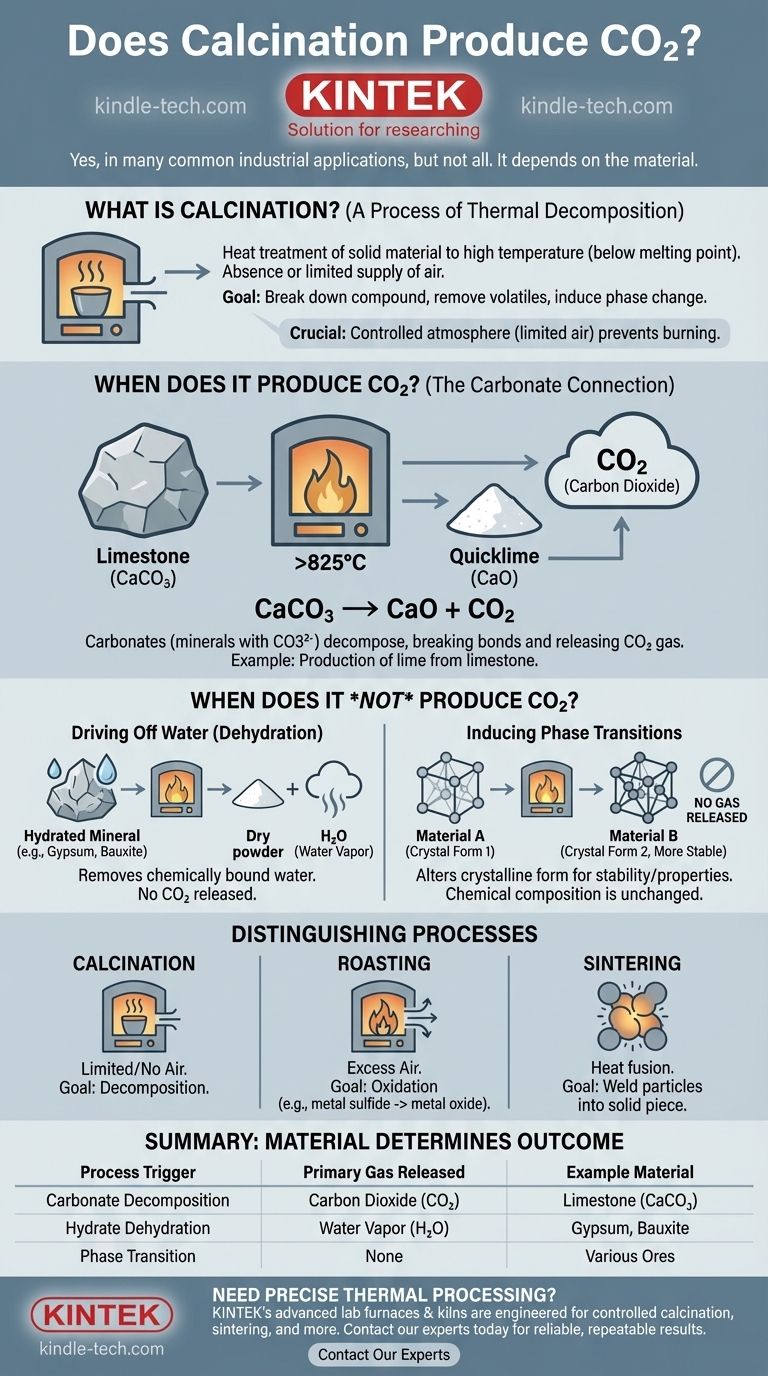
En muchas aplicaciones industriales comunes, sí. La calcinación es un proceso de calentamiento y, cuando se aplica a materiales que contienen carbonato, como la piedra caliza, provoca una descomposición química que libera cantidades significativas de dióxido de carbono (CO2). La producción de cal a partir de piedra caliza es un ejemplo principal de esta reacción.
El punto crítico a entender es que la calcinación es un proceso, no una única reacción específica. Si produce CO2 depende completamente de la composición química del material que se calienta.

¿Qué es fundamentalmente la calcinación?
Un proceso de descomposición térmica
La calcinación es un proceso de tratamiento térmico en el que un material sólido se calienta a una temperatura alta, pero por debajo de su punto de fusión. Esto se realiza en ausencia o con un suministro muy limitado de aire.
El propósito principal es inducir la descomposición térmica, lo que significa descomponer el compuesto mediante calor.
El objetivo: inducir el cambio
El objetivo de la calcinación no siempre es el mismo. Se puede utilizar para:
- Eliminar una sustancia volátil, como CO2 de la piedra caliza o agua de un mineral hidratado.
- Eliminar impurezas de un mineral.
- Provocar una transición de fase, cambiando la estructura cristalina y las propiedades del material.
El papel de la atmósfera
La atmósfera controlada (aire limitado) es crucial. Evita que el material se queme u oxide, lo que distingue la calcinación de otros tratamientos térmicos como la tostación.
¿Cuándo produce CO2 la calcinación?
La conexión del carbonato
La calcinación produce dióxido de carbono cuando la materia prima es un carbonato. Los carbonatos son minerales que contienen el ion carbonato (CO3²⁻).
Cuando se calientan, estos minerales se descomponen, rompiendo sus enlaces químicos y liberando los átomos de carbono y oxígeno como gas CO2.
Ejemplo: Producción de cal a partir de piedra caliza
El ejemplo más clásico es la calcinación de piedra caliza (carbonato de calcio, CaCO₃).
Cuando se calienta por encima de 825 °C (1517 °F), se descompone en óxido de calcio (CaO), también conocido como cal viva, y libera dióxido de carbono. La reacción química es: CaCO₃ → CaO + CO₂.
Otros minerales carbonatados
Este principio se aplica también a otros minerales carbonatados, como la magnesita (MgCO₃) o la dolomita (CaMg(CO₃)₂), que también liberan CO2 al calentarse.
¿Cuándo no produce CO2 la calcinación?
Eliminación de agua (deshidratación)
Muchos minerales se calcina simplemente para eliminar el agua (H₂O) que está químicamente unida dentro de su estructura cristalina.
Por ejemplo, la calcinación del mineral de bauxita para producir alúmina (óxido de aluminio) o el calentamiento del yeso para producir yeso de París liberan vapor de agua, no dióxido de carbono.
Inducción de transiciones de fase
A veces, un material se calcina simplemente para alterar su forma cristalina. Esto puede hacerlo más estable, más reactivo o darle diferentes propiedades físicas.
En estos casos, la composición química no cambia y no se libera ningún gas.
Distinción entre calcinación y procesos similares
Calcinación frente a tostación
La tostación es el calentamiento de un mineral en presencia de un exceso de aire. Su objetivo suele ser la oxidación, como convertir un sulfuro metálico en un óxido metálico. La calcinación se realiza con aire limitado o nulo para provocar la descomposición.
Calcinación frente a sinterización
La sinterización utiliza el calor para fusionar partículas pequeñas en una sola pieza sólida, a menudo después de que las impurezas ya han sido eliminadas. La calcinación descompone un material; la sinterización lo une.
Tomar la decisión correcta para su objetivo
Comprender el material de partida es la clave para predecir el resultado.
- Si su material es un carbonato (como piedra caliza o dolomita): Espere una producción significativa de CO2 como resultado principal del proceso.
- Si su material es un hidrato (como bauxita o yeso): La emisión principal será vapor de agua (vapor), no CO2.
- Si su objetivo es cambiar la estructura cristalina de un material: El proceso puede no liberar ningún gas en absoluto.
En última instancia, la calcinación es una herramienta versátil definida por el calor y una atmósfera controlada, mientras que sus resultados específicos están dictados por la química.
Tabla de resumen:
| Disparador del proceso | Gas principal liberado | Material de ejemplo |
|---|---|---|
| Descomposición del carbonato | Dióxido de carbono (CO₂) | Piedra caliza (CaCO₃) |
| Deshidratación de hidratos | Vapor de agua (H₂O) | Yeso, Bauxita |
| Transición de fase | Ninguno | Varios minerales |
¿Necesita un procesamiento térmico preciso para sus materiales? Los hornos y kilns de laboratorio avanzados de KINTEK están diseñados para la calcinación, sinterización y más procesos controlados. Ya sea que esté procesando carbonatos, hidratos u otros materiales, nuestro equipo garantiza un control preciso de la temperatura y la gestión de la atmósfera para obtener resultados fiables y repetibles. Contacte con nuestros expertos hoy mismo para encontrar la solución térmica perfecta para las necesidades específicas de su laboratorio.
Guía Visual
Productos relacionados
- Horno Rotatorio de Inclinación de Vacío de Laboratorio Horno de Tubo Giratorio
- Horno Rotatorio Eléctrico Pequeño Horno Rotatorio para Regeneración de Carbón Activado
- Horno de Tubo Rotatorio Continuo Sellado al Vacío Horno de Tubo Giratorio
- Horno de Tubo de Cuarzo para Procesamiento Térmico Rápido (RTP) de Laboratorio
- Horno de mufla de 1800℃ para laboratorio
La gente también pregunta
- ¿Por qué se utiliza un horno de alta temperatura con prueba de múltiples sondas para la perovskita ABO3? Obtenga datos precisos de conductividad
- ¿Qué es un horno rotatorio de tipo térmico? La guía definitiva para un calentamiento y mezclado uniformes
- ¿Cuál es el propósito del pretratamiento de las muestras de carbón? Asegure una pirólisis precisa con secado con nitrógeno
- ¿Cuál es el proceso de producción del circonio? Del mineral al metal y la cerámica de alto rendimiento
- ¿Cuáles son las ventajas del proceso de utilizar un horno tubular rotatorio para el polvo de WS2? Lograr una cristalinidad superior del material



















