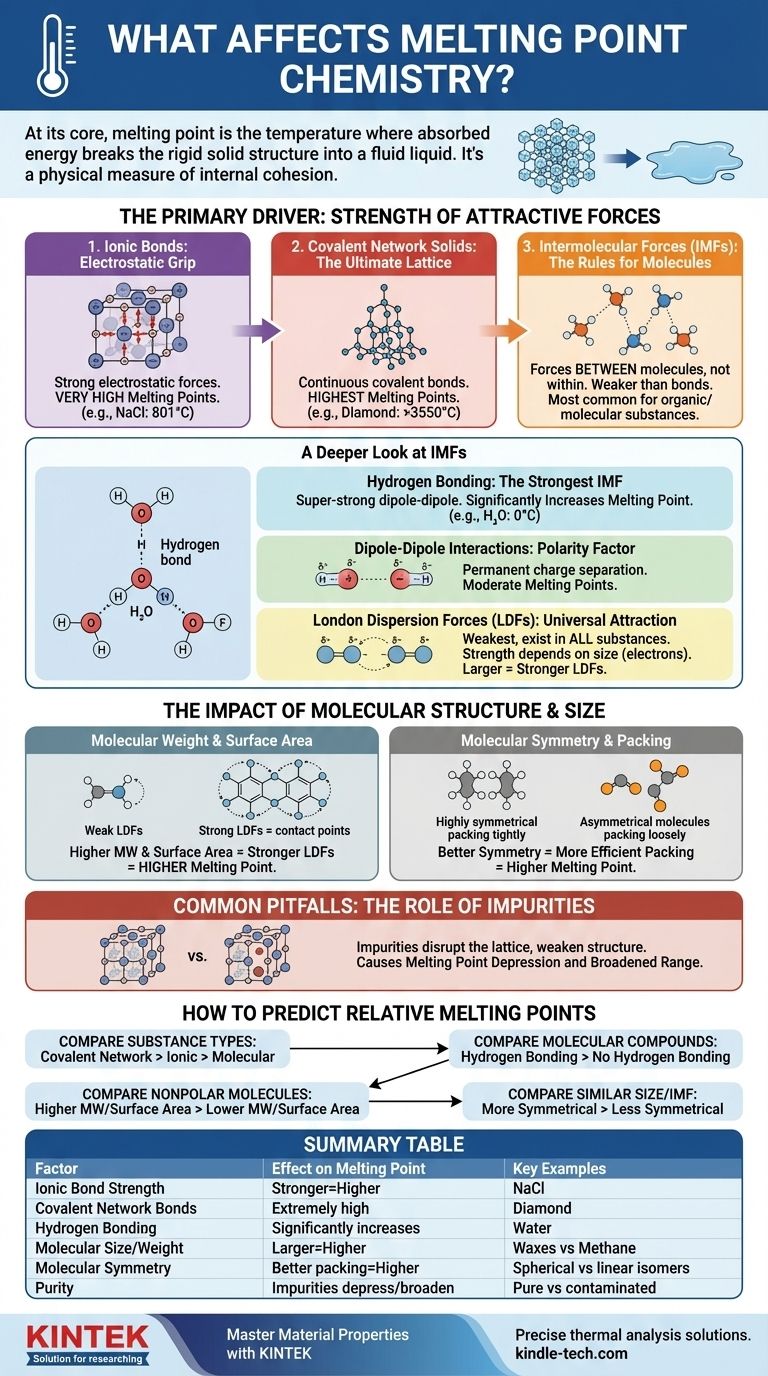
En esencia, el punto de fusión de una sustancia es la temperatura a la que ha absorbido suficiente energía para romper la estructura rígida y ordenada de un sólido y pasar a un líquido desordenado y fluido. Esto está determinado por dos factores principales: la fuerza de las fuerzas de atracción que mantienen unidas a las partículas (átomos, iones o moléculas) y la eficiencia con la que esas partículas se empaquetan en una red cristalina sólida.
El punto de fusión no es solo un número; es una medida física de la cohesión interna de una sustancia. Para entenderlo, primero debe identificar la fuerza dominante que mantiene unidas a las partículas, ya sea un poderoso enlace iónico o una débil atracción intermolecular, y luego considerar cómo el tamaño y la forma molecular refinan ese valor.

El impulsor principal: la fuerza de las atracciones
La cantidad de energía necesaria para desorganizar una red sólida es directamente proporcional a la fuerza de las fuerzas que la mantienen unida. Estas fuerzas existen en un vasto espectro, desde enlaces químicos increíblemente fuertes hasta fuerzas intermoleculares mucho más débiles.
Enlaces Iónicos: El agarre electrostático
Los compuestos iónicos, como la sal de mesa (NaCl), se mantienen unidos por potentes atracciones electrostáticas entre iones positivos y negativos. Estas fuerzas crean una red cristalina muy estable.
Superar estas fuertes atracciones requiere una enorme cantidad de energía térmica, razón por la cual los compuestos iónicos suelen tener puntos de fusión muy altos.
Sólidos de Red Covalente: La red definitiva
En un sólido de red covalente, como el diamante o el cuarzo (SiO₂), los átomos no solo se atraen entre sí; están unidos por una red continua de fuertes enlaces covalentes. No hay moléculas individuales que separar.
Para fundir una sustancia así, se deben empezar a romper estos potentes enlaces covalentes. Esto requiere más energía que cualquier otro tipo de interacción, lo que confiere a estos materiales los puntos de fusión más altos de todas las sustancias.
Fuerzas Intermoleculares (FIM): Las reglas para las moléculas
Para los compuestos moleculares (como el agua, el azúcar o la cera), el punto de fusión no se trata de romper los enlaces covalentes dentro de las moléculas. Se trata de superar las fuerzas de atracción más débiles entre las moléculas. Estas se conocen como fuerzas intermoleculares (FIM).
Una mirada más profunda a las fuerzas intermoleculares (FIM)
El tipo y la fuerza de las FIM son el factor más importante para determinar el punto de fusión de la mayoría de las sustancias orgánicas y moleculares. Generalmente son mucho más débiles que los enlaces químicos completos.
Puentes de Hidrógeno: La FIM más fuerte
Este es un tipo especial y súper fuerte de interacción dipolo-dipolo que ocurre cuando el hidrógeno está unido a un átomo altamente electronegativo como el nitrógeno (N), el oxígeno (O) o el flúor (F).
La atracción resultante entre moléculas es significativa. El agua (H₂O) es un ejemplo clásico; sus puentes de hidrógeno le dan un punto de fusión mucho más alto (0 °C) de lo que se esperaría para una molécula de su tamaño.
Interacciones Dipolo-Dipolo: El factor polaridad
Las moléculas polares tienen una separación permanente de carga, creando un extremo positivo y uno negativo, como pequeños imanes. Estos "polos" moleculares se atraen entre sí.
Estas fuerzas son más fuertes que las fuerzas entre moléculas no polares de tamaño similar, lo que da lugar a puntos de fusión moderados.
Fuerzas de Dispersión de London (FDL): La atracción universal
Las FDL son el tipo más débil de FIM y existen en todas las sustancias. Surgen de las fluctuaciones aleatorias y temporales en la distribución de electrones alrededor de una molécula, lo que crea dipolos fugaces e instantáneos.
La fuerza de las FDL depende directamente del tamaño de la molécula (específicamente, su número de electrones). Las moléculas más grandes tienen nubes de electrones más grandes y "más blandas", lo que las hace más polarizables y conduce a FDL más fuertes. Esta es la razón por la cual las moléculas grandes y no polares como la cera pueden seguir siendo sólidas a temperatura ambiente.
El impacto de la estructura y el tamaño molecular
Más allá del tipo de fuerza, la forma y el tamaño específicos de una molécula juegan un papel fundamental en el ajuste fino de su punto de fusión.
Peso Molecular y Área Superficial
Para moléculas con la misma FIM dominante (por ejemplo, al comparar dos moléculas no polares), aquella con el mayor peso molecular tendrá FDL más fuertes y, por lo tanto, un punto de fusión más alto. Una mayor área superficial permite más puntos de contacto entre las moléculas, fortaleciendo también las FDL.
Simetría Molecular y Empaquetamiento
La simetría tiene un efecto profundo. Las moléculas altamente simétricas pueden empaquetarse de manera más eficiente y compacta en una red cristalina estable, como ladrillos LEGO bien hechos.
Esta disposición densa y ordenada requiere más energía para romperse. Por lo tanto, una molécula más simétrica a menudo tendrá un punto de fusión significativamente más alto que un isómero menos simétrico, incluso si tienen la misma fórmula y peso.
Errores comunes a evitar: el papel de las impurezas
En un contexto práctico y del mundo real, uno de los factores más comunes que afectan el punto de fusión es la pureza de la muestra.
Alteración de la Red Cristalina
Las impurezas son partículas extrañas que no encajan perfectamente en la red cristalina de la sustancia. Introducen defectos y debilitan la estructura general.
Debido a que la red ya está alterada, se necesita menos energía para romperla, lo que resulta en un punto de fusión más bajo. Este fenómeno se conoce como descenso crioscópico (o depresión del punto de fusión).
Un rango de fusión ampliado
Una sustancia pura generalmente se funde en un rango de temperatura muy estrecho (a menudo menos de 1 °C). La presencia de impurezas no solo reduce el punto de fusión, sino que también hace que la sustancia se funda en un rango de temperatura más amplio y extenso. Los químicos utilizan esta característica para evaluar la pureza de un compuesto sintetizado.
Cómo predecir puntos de fusión relativos
Al comparar dos sustancias, siga esta jerarquía de preguntas para hacer una predicción precisa.
- Si su enfoque principal es comparar diferentes tipos de sustancias: Un sólido de red covalente (diamante) tendrá un punto de fusión más alto que un compuesto iónico (sal), que a su vez será mucho más alto que el de un compuesto molecular (azúcar).
- Si su enfoque principal es comparar dos compuestos moleculares: Primero, verifique la presencia de puentes de hidrógeno. La molécula que puede formar puentes de hidrógeno casi siempre tendrá un punto de fusión más alto que aquella que no puede, suponiendo un tamaño similar.
- Si su enfoque principal es comparar dos moléculas no polares: La molécula con mayor peso molecular y mayor área superficial tendrá fuerzas de dispersión de London más fuertes y un punto de fusión más alto.
- Si su enfoque principal es comparar dos moléculas de tamaño y tipo de FIM similares: La molécula más simétrica que pueda empaquetarse de manera más eficiente en una red cristalina probablemente tendrá el punto de fusión más alto.
Comprender estos factores transforma el punto de fusión de un simple dato a un poderoso indicador de las fuerzas moleculares fundamentales y la estructura de una sustancia.
Tabla de resumen:
| Factor | Efecto en el punto de fusión | Ejemplos clave |
|---|---|---|
| Fuerza del Enlace Iónico | Enlaces más fuertes = Punto de fusión más alto | Cloruro de Sodio (NaCl): 801°C |
| Enlaces de Red Covalente | Puntos de fusión extremadamente altos | Diamante: >3550°C |
| Puentes de Hidrógeno | Aumenta significativamente el punto de fusión | Agua (H₂O): 0°C |
| Tamaño/Peso Molecular | Moléculas más grandes = Punto de fusión más alto (FDL más fuertes) | Ceras (MW alto) vs. Metano (MW bajo) |
| Simetría Molecular | Mejor empaquetamiento = Punto de fusión más alto | Isómeros esféricos frente a lineales |
| Pureza | Las impurezas deprimen y amplían el rango de fusión | Muestras puras frente a contaminadas |
Domine las propiedades de los materiales con KINTEK
Comprender los puntos de fusión es fundamental para la selección de materiales, la síntesis y el control de calidad en el laboratorio. Ya sea que esté desarrollando nuevos compuestos o analizando la pureza de los materiales, contar con el equipo adecuado es esencial.
KINTEK se especializa en equipos y consumibles de laboratorio de alta calidad diseñados para ofrecer un análisis térmico preciso y fiable. Nuestros productos ayudan a investigadores y profesionales de laboratorio a determinar con precisión los puntos de fusión y a comprender el comportamiento de los materiales.
¿Listo para mejorar las capacidades de su laboratorio? Contacte con nuestros expertos hoy mismo para encontrar la solución perfecta para sus necesidades de análisis térmico.
Guía Visual
Productos relacionados
- Horno de tratamiento térmico al vacío y horno de fusión por inducción de levitación
- Horno de Fusión por Inducción al Vacío a Escala de Laboratorio
- Horno de Fusión por Inducción al Vacío para Fusión por Inducción
- Máquina de prensa hidráulica calentada con placas calentadas manuales integradas para uso en laboratorio
- Horno de Fusión por Inducción de Arco al Vacío No Consumible
La gente también pregunta
- ¿Cuál es el mejor disolvente para la extracción de cannabis? Encuentre la elección ideal para los objetivos de su producto
- ¿Por qué es necesario utilizar un horno de secado a alta temperatura para el reciclaje de lodos de aluminio? Garantizar la precisión de los datos
- ¿Cuáles son los diferentes tipos de técnicas de muestreo utilizadas en la espectroscopia IR? Una guía de los métodos KBr, Mull y ATR
- ¿Cuál es la mejor manera de unir acero inoxidable? Una guía sobre soldadura, soldadura fuerte y sujeción mecánica
- ¿Se utilizan los diamantes en las máquinas? Desbloquee un rendimiento superior con herramientas de diamante
- ¿Qué es una máquina de pulverización catódica? Logre una deposición de película delgada de alta precisión
- ¿Qué sustancias se pueden separar por centrifugación? Separar sólidos, líquidos y biomoléculas
- ¿Cuál es la función de un horno de precisión de laboratorio en la preparación de GLYMO-rGO? Asegura una dispersión óptima de los nano-rellenos





















