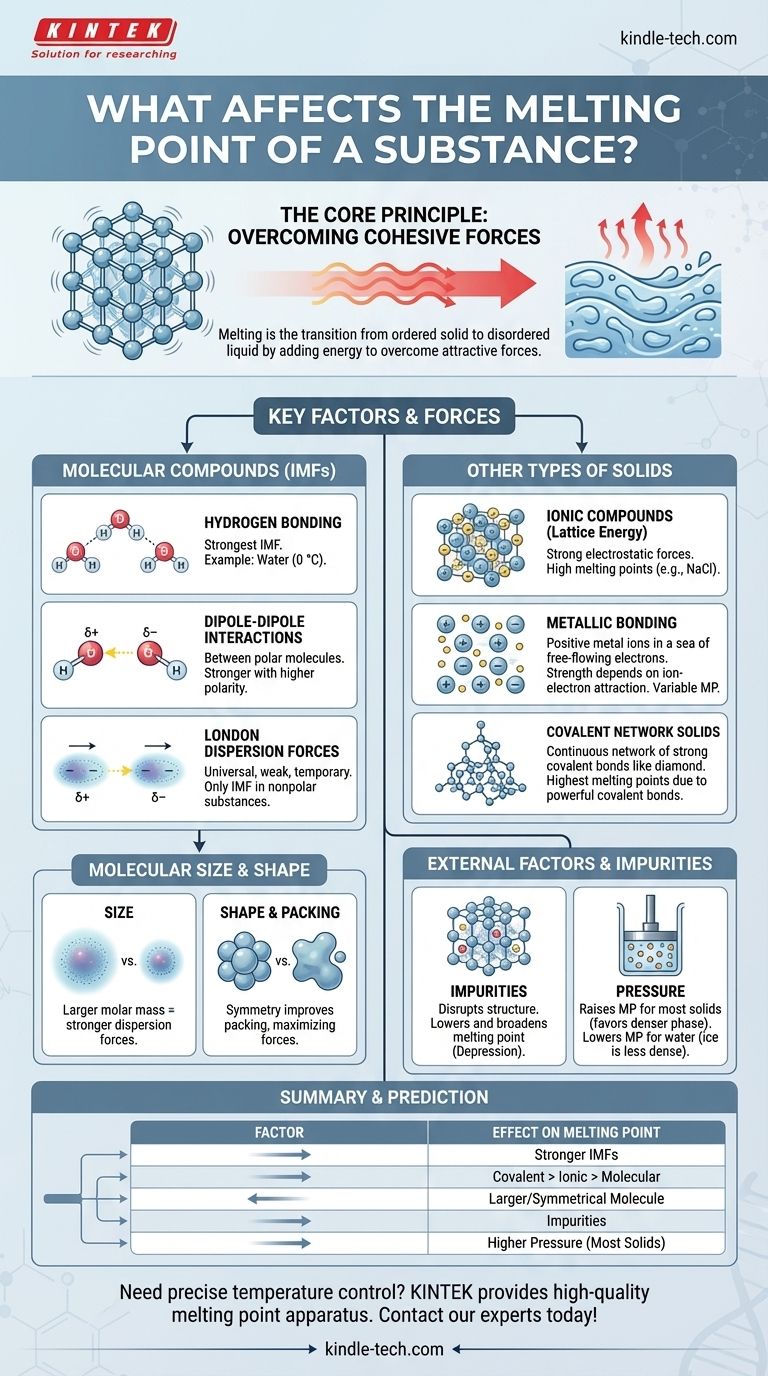
En esencia, el punto de fusión de una sustancia está determinado por la energía necesaria para superar las fuerzas de atracción que mantienen a sus partículas en una estructura tridimensional fija. Los factores principales son la fuerza de estas fuerzas —ya sean enlaces químicos o fuerzas intermoleculares más débiles— y la forma en que las partículas se empaquetan. Factores como el tamaño molecular, la forma y la presencia de impurezas también juegan un papel crucial.
El principio central es simple: las fuerzas de atracción más fuertes entre las partículas requieren más energía térmica para romperse, lo que resulta en un punto de fusión más alto. Toda la historia de los puntos de fusión es una exploración de lo que crea y modifica estas fuerzas.

El Principio Central: Superar las Fuerzas Cohesivas
La fusión es una transformación física de un estado sólido ordenado a un estado líquido desordenado. Comprender esta transición es clave para entender los factores que la controlan.
¿Qué es la Fusión?
En un sólido, los átomos, iones o moléculas están fijos en una disposición determinada llamada red cristalina. Vibran en su lugar pero no se mueven unos sobre otros.
La fusión ocurre a la temperatura específica en la que estas partículas ganan suficiente energía cinética del calor para liberarse de sus posiciones fijas y comenzar a fluir.
Energía vs. Cohesión
El calor que se añade a una sustancia aumenta la energía cinética de sus partículas, haciendo que vibren con más intensidad. El punto de fusión es la temperatura de equilibrio donde esta energía vibratoria se vuelve lo suficientemente potente como para superar las fuerzas cohesivas que mantienen unida la red.
Factores Clave para Compuestos Moleculares
Para las sustancias compuestas de moléculas discretas (como el agua, la cera o el azúcar), las fuerzas entre las moléculas —no los enlaces dentro de ellas— son las que se rompen durante la fusión. Estas se denominan fuerzas intermoleculares (FIM).
El Enlace de Hidrógeno: La FIM más Fuerte
El enlace de hidrógeno es un tipo potente de interacción dipolo-dipolo que ocurre cuando el hidrógeno está unido a un átomo altamente electronegativo como el nitrógeno (N), el oxígeno (O) o el flúor (F).
El agua ($\text{H}_2\text{O}$) es un ejemplo clásico. Su alto punto de fusión ($0\text{ °C}$) en comparación con moléculas de tamaño similar se debe enteramente a la fuerte red de enlaces de hidrógeno que mantienen unidas a las moléculas en el hielo.
Interacciones Dipolo-Dipolo
Estas fuerzas existen entre moléculas polares, que tienen extremos parciales positivos y negativos permanentes. El extremo positivo de una molécula atrae al extremo negativo de su vecina.
Cuanto mayor sea la polaridad de la molécula, más fuerte será la atracción dipolo-dipolo y mayor será el punto de fusión.
Fuerzas de Dispersión de London: La Fuerza Universal
Estas atracciones temporales y débiles existen en todas las moléculas, tanto polares como no polares. Surgen de fluctuaciones momentáneas en la nube de electrones alrededor de una molécula, creando dipolos fugaces.
Para las sustancias no polares como el metano ($\text{CH}_4$) u octano ($\text{C}_8\text{H}_{18}$), las fuerzas de dispersión de London son las únicas FIM presentes.
El Papel del Tamaño y la Forma Molecular
Tamaño (Masa Molar): Las moléculas más grandes tienen nubes de electrones más grandes, que son más fáciles de distorsionar. Esto conduce a fuerzas de dispersión de London más fuertes y, en consecuencia, a puntos de fusión más altos. Por eso los hidrocarburos cerosos grandes son sólidos a temperatura ambiente, mientras que los pequeños como el metano son gases.
Simetría y Empaquetamiento: Las moléculas que son simétricas y compactas pueden empaquetarse de manera más ajustada y eficiente en una red cristalina. Este empaquetamiento cercano maximiza la efectividad de las fuerzas intermoleculares, lo que resulta en un punto de fusión más alto que para los isómeros de forma irregular del mismo tamaño.
Más Allá de las Moléculas: Otros Tipos de Sólidos
No todos los sólidos están formados por moléculas discretas. En muchos materiales, la fusión requiere romper potentes enlaces químicos que se extienden por toda la estructura.
Compuestos Iónicos y Energía Reticular
En los compuestos iónicos como la sal de mesa ($\text{NaCl}$), los iones positivos y negativos se mantienen en una red rígida mediante fuertes fuerzas electrostáticas (enlaces iónicos). La fusión de estas sustancias requiere superar esta inmensa atracción, que se mide por la energía reticular.
Debido a que los enlaces iónicos son mucho más fuertes que las fuerzas intermoleculares, los compuestos iónicos tienen puntos de fusión muy altos.
Metales y Enlace Metálico
Los metales se mantienen unidos por enlaces metálicos, donde un "mar" de electrones deslocalizados fluye libremente entre una red fija de iones metálicos positivos.
La fuerza de la atracción entre los iones y este mar de electrones determina el punto de fusión. Los metales como el tungsteno y el titanio forman enlaces metálicos muy fuertes y tienen puntos de fusión excepcionalmente altos.
Sólidos de Red Covalente
En estos materiales, los átomos están unidos por una red continua de fuertes enlaces covalentes. No hay moléculas individuales.
Para fundir un sólido de red covalente como el diamante (carbono) o el cuarzo (dióxido de silicio), se deben romper estos potentes enlaces covalentes. Esto requiere una cantidad tremenda de energía, dándoles los puntos de fusión más altos de cualquier clase de sustancia.
Comprensión de las Compensaciones y Factores Externos
Las propiedades intrínsecas de una sustancia no son la única influencia. Las condiciones externas y la composición también tienen un impacto significativo.
El Efecto de las Impurezas: Descenso Crioscópico
La presencia de una impureza interrumpe la estructura uniforme de una red cristalina. Esta red debilitada y desorganizada requiere menos energía para romperse.
Este fenómeno se conoce como descenso crioscópico (o depresión del punto de fusión). Es la razón por la cual una sustancia pura tiene un punto de fusión nítido y definido, mientras que una sustancia impura se funde en un rango de temperatura amplio y más bajo. También es el principio detrás del uso de sal para derretir el hielo en las carreteras invernales.
La Influencia de la Presión
Para la mayoría de las sustancias, la fase sólida es más densa que la fase líquida. Aumentar la presión favorece el estado más denso, acercando a las partículas y dificultando que se liberen. Por lo tanto, para la mayoría de los materiales, una presión más alta eleva el punto de fusión.
El agua es una excepción famosa. Debido a que el hielo es menos denso que el agua líquida, aumentar la presión favorece el estado líquido, por lo tanto, disminuye el punto de fusión.
Cómo Predecir Puntos de Fusión Relativos
Utilice estos principios para comparar diferentes sustancias y predecir su comportamiento.
- Si está comparando un compuesto de red covalente, uno iónico y uno molecular: El de red covalente (ej. diamante) será el más alto, seguido por el iónico (ej. sal), y el compuesto molecular (ej. azúcar) será mucho más bajo.
- Si está comparando compuestos moleculares: Primero, verifique si hay enlaces de hidrógeno, que son un factor dominante. Si están ausentes, compare la polaridad. Si todos son no polares o tienen polaridad similar, el que tenga mayor masa molar generalmente tendrá el punto de fusión más alto.
- Si está comparando compuestos iónicos: El compuesto con cargas iónicas más altas y/o radios iónicos más pequeños tendrá una energía reticular más fuerte y un punto de fusión más alto.
- Si necesita evaluar la pureza: Una sustancia que se funde bruscamente a su punto de fusión conocido probablemente sea pura, mientras que una que se funde gradualmente en un rango por debajo de su punto esperado es impura.
Al comprender estas fuerzas fundamentales, puede predecir eficazmente cómo la estructura microscópica de una sustancia dicta su comportamiento de fusión.
Tabla Resumen:
| Factor | Efecto en el Punto de Fusión | Principio Clave |
|---|---|---|
| Fuerzas Intermoleculares (FIM) | Mayor con FIM más fuertes | Enlace de hidrógeno > dipolo-dipolo > dispersión de London |
| Tipo de Enlace Químico | Red covalente > Iónico > Metálico > Molecular | Fuerza de los enlaces que deben romperse |
| Tamaño/Forma Molecular | Mayor con mayor masa molar y forma simétrica | Aumenta las fuerzas de London y mejora el empaquetamiento de la red |
| Impurezas | Disminuye (Descenso Crioscópico) | Interrumpe la red cristalina, requiriendo menos energía para fundirse |
| Presión | Aumenta (para la mayoría de los sólidos); Disminuye (para hielo/agua) | Favorece la fase más densa (sólido para la mayoría, líquido para el agua) |
¿Necesita un control preciso de la temperatura para el análisis de sus materiales? Comprender los puntos de fusión es fundamental para la caracterización de materiales, la evaluación de la pureza y el desarrollo de procesos. KINTEK se especializa en proporcionar equipos de laboratorio de alta calidad, incluyendo aparatos de punto de fusión y hornos, para ayudar a su laboratorio a lograr resultados precisos y fiables. ¡Contacte con nuestros expertos hoy mismo para encontrar la solución perfecta para su aplicación específica!
Guía Visual
Productos relacionados
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Qué es la pirólisis de lodos? Transformar los residuos en energía y recursos
- ¿Cuál es el propósito del tratamiento térmico? Libere todo el potencial de su material
- ¿Aumenta el tratamiento térmico la resistencia de un material? Adapte las propiedades de su material
- ¿Cuál es el componente central de una bomba peristáltica? El tubo flexible explicado
- ¿Por qué es necesario el tratamiento térmico a alta temperatura para los escudos compuestos de PEEK y tungsteno impresos en 3D?
- ¿Cómo funciona la pulverización catódica por magnetrón de CC? Logre una deposición superior de películas delgadas
- ¿Cuál es la eficiencia de la pirólisis de plásticos? Una inmersión profunda en el rendimiento másico, el balance energético y la viabilidad económica
- ¿Cuáles son los beneficios de usar un horno de secado al vacío para nanopartículas de Fe-C@C? Preservar la estructura y la integridad química



















