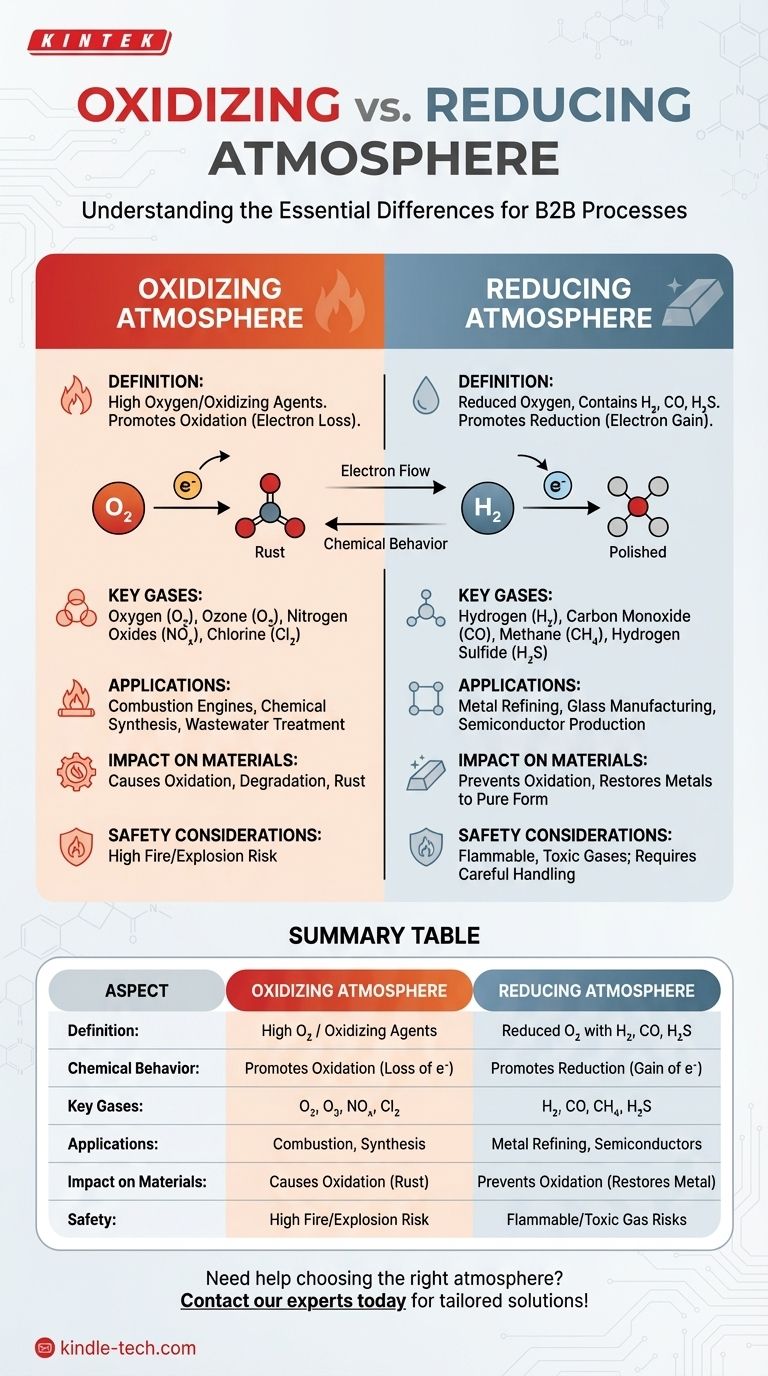
Una atmósfera oxidante contiene una alta concentración de oxígeno u otros agentes oxidantes, lo que promueve las reacciones de oxidación, mientras que una atmósfera reductora tiene una cantidad reducida de oxígeno y puede contener gases como hidrógeno, monóxido de carbono o sulfuro de hidrógeno, que previenen la oxidación y fomentan las reacciones de reducción. La diferencia clave radica en el comportamiento químico del entorno: las atmósferas oxidantes facilitan la pérdida de electrones (oxidación), mientras que las atmósferas reductoras promueven la ganancia de electrones (reducción). Estas diferencias son fundamentales en aplicaciones como la metalurgia, la fabricación química y el procesamiento de materiales, donde el control de la atmósfera puede influir significativamente en el resultado de las reacciones.

Puntos clave explicados:
-
Definición de atmósfera oxidante:
- Una atmósfera oxidante se caracteriza por una alta concentración de oxígeno u otros agentes oxidantes.
- Promueve reacciones de oxidación, donde las sustancias pierden electrones.
- Los ejemplos comunes incluyen el aire (que contiene aproximadamente un 21% de oxígeno) y entornos con ozono o óxidos de nitrógeno.
- Las aplicaciones incluyen procesos de combustión, oxidación de metales y ciertas síntesis químicas.
-
Definición de atmósfera reductora:
- Una atmósfera reductora contiene una cantidad reducida de oxígeno y puede incluir gases como hidrógeno, monóxido de carbono o sulfuro de hidrógeno.
- Previene la oxidación y fomenta las reacciones de reducción, donde las sustancias ganan electrones.
- Los ejemplos comunes incluyen entornos utilizados en procesos metalúrgicos (por ejemplo, fundición) o conservación de alimentos (por ejemplo, envasado al vacío).
- Las aplicaciones incluyen refino de metales, fabricación de vidrio y producción de semiconductores.
-
Comportamiento químico:
- Atmósfera oxidante: Facilita la pérdida de electrones de las sustancias, lo que conduce a la oxidación. Por ejemplo, el hierro reacciona con el oxígeno para formar óxido de hierro (herrumbre).
- Atmósfera reductora: Promueve la ganancia de electrones, lo que conduce a la reducción. Por ejemplo, el gas hidrógeno puede reducir el óxido de hierro de nuevo a hierro metálico.
-
Gases clave involucrados:
- Atmósfera oxidante: Oxígeno (O₂), ozono (O₃), óxidos de nitrógeno (NOₓ) y cloro (Cl₂).
- Atmósfera reductora: Hidrógeno (H₂), monóxido de carbono (CO), metano (CH₄) y sulfuro de hidrógeno (H₂S).
-
Aplicaciones e implicaciones:
-
Atmósfera oxidante:
- Se utiliza en motores de combustión, síntesis química (por ejemplo, producción de ácido sulfúrico) y tratamiento de aguas residuales.
- Puede causar corrosión o degradación de los materiales con el tiempo.
-
Atmósfera reductora:
- Se utiliza en la extracción de metales (por ejemplo, reducción de mineral de hierro a hierro), fabricación de vidrio (para eliminar impurezas) y envasado de alimentos (para prevenir el deterioro).
- Previene la oxidación, preservando la integridad de los materiales o productos.
-
Atmósfera oxidante:
-
Ejemplos en la industria:
- Atmósfera oxidante: En la producción de acero, se sopla oxígeno al hierro fundido para eliminar impurezas (por ejemplo, carbono) mediante oxidación.
- Atmósfera reductora: En la producción de obleas de silicio para semiconductores, se utiliza una atmósfera reductora para evitar la oxidación de la superficie del silicio.
-
Impacto en los materiales:
- Atmósfera oxidante: Puede provocar la formación de óxidos, lo que puede degradar los materiales (por ejemplo, óxido en los metales).
- Atmósfera reductora: Puede restaurar los metales a su forma pura eliminando óxidos (por ejemplo, reduciendo el óxido de hierro a hierro).
-
Consideraciones ambientales y de seguridad:
- Atmósfera oxidante: Los altos niveles de oxígeno aumentan el riesgo de incendio o explosiones.
- Atmósfera reductora: Gases como el hidrógeno o el monóxido de carbono son inflamables y tóxicos, lo que requiere una manipulación cuidadosa.
Al comprender estas diferencias, los compradores de equipos y consumibles pueden tomar decisiones informadas sobre el tipo de atmósfera requerida para procesos específicos, asegurando resultados óptimos y seguridad.
Tabla de resumen:
| Aspecto | Atmósfera oxidante | Atmósfera reductora |
|---|---|---|
| Definición | Alta concentración de oxígeno u agentes oxidantes. | Niveles reducidos de oxígeno con gases como hidrógeno, monóxido de carbono o sulfuro de hidrógeno. |
| Comportamiento químico | Promueve la oxidación (pérdida de electrones). | Promueve la reducción (ganancia de electrones). |
| Gases clave | Oxígeno (O₂), ozono (O₃), óxidos de nitrógeno (NOₓ), cloro (Cl₂). | Hidrógeno (H₂), monóxido de carbono (CO), metano (CH₄), sulfuro de hidrógeno (H₂S). |
| Aplicaciones | Motores de combustión, síntesis química, tratamiento de aguas residuales. | Refino de metales, fabricación de vidrio, producción de semiconductores. |
| Impacto en los materiales | Causa oxidación (por ejemplo, óxido). | Previene la oxidación, restaura los metales a su forma pura. |
| Consideraciones de seguridad | Los altos niveles de oxígeno aumentan los riesgos de incendio/explosión. | Los gases inflamables y tóxicos requieren manipulación cuidadosa. |
¿Necesita ayuda para elegir la atmósfera adecuada para su proceso? ¡Póngase en contacto con nuestros expertos hoy mismo para obtener soluciones personalizadas!
Guía Visual
Productos relacionados
- Horno de Atmósfera Controlada de 1200℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno Tubular Rotatorio de Múltiples Zonas de Calentamiento Dividido
La gente también pregunta
- ¿Qué papel juega un horno de atmósfera a alta temperatura en la producción de óxido de grafeno 3D? Desbloquea la exfoliación avanzada
- ¿Cuál es el papel de un horno de atmósfera en la preparación de óxido de grafeno a base de lignina? Perspectivas clave de carbonización
- ¿Qué papel juega un horno de atmósfera controlada en PIP? Lograr pirólisis de cerámica de alta resistencia
- ¿Se puede usar argón para enfriar? Sí, para aplicaciones especializadas que requieren inercia química.
- ¿Cuál es la importancia de la atmósfera controlada en el tratamiento térmico? Prevenir la oxidación y garantizar la integridad de la pieza
- ¿Qué es la atmósfera inerte? Una guía para controlar las reacciones químicas
- ¿Cómo influye un sistema de control de atmósfera en los compuestos de madera y plástico? Domina la estabilidad térmica y la seguridad del material
- ¿Cómo mejora un horno de calentamiento con un sistema de control de hidrógeno la eficiencia de desoxidación? (Explicación del Proceso HAMR)



















