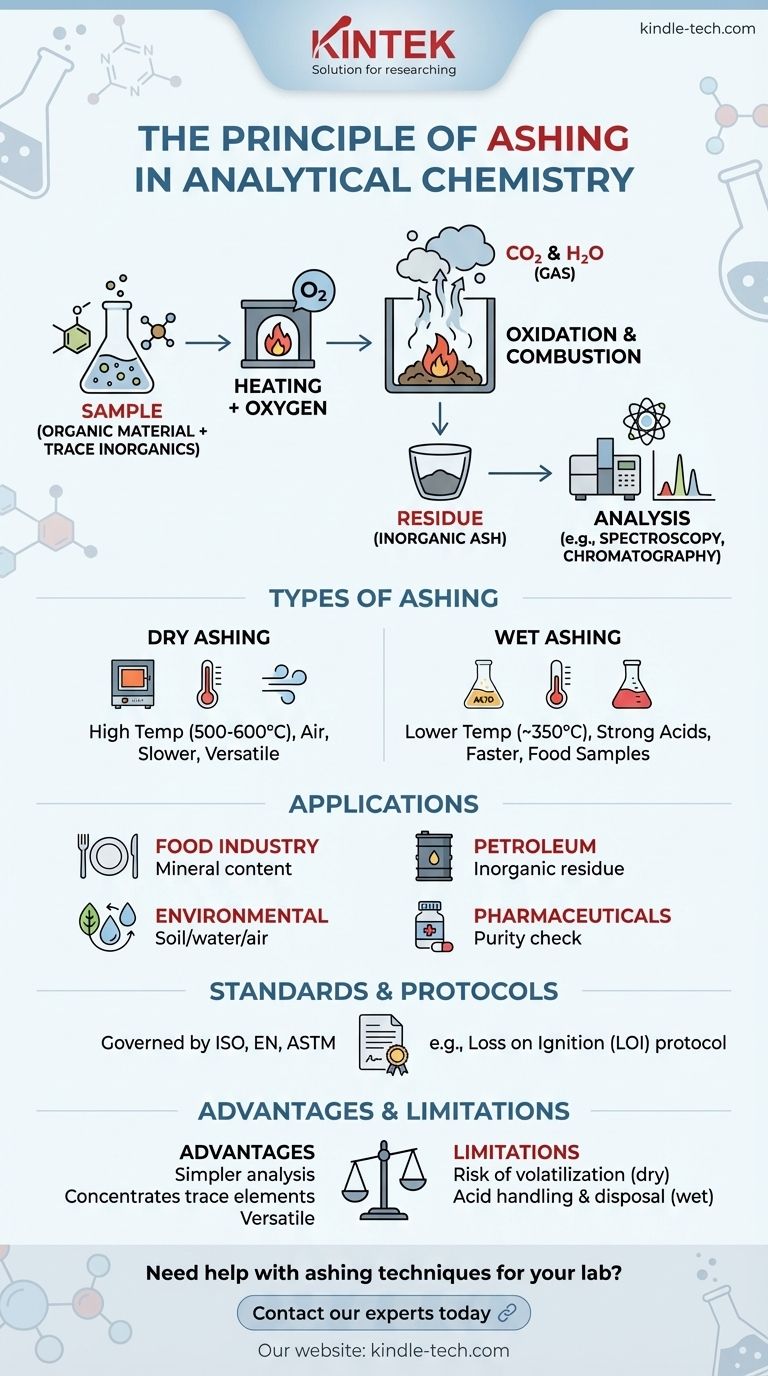
La calcinación es un proceso fundamental en química analítica que se utiliza para eliminar la materia orgánica de una muestra, dejando atrás cenizas inorgánicas no combustibles para su posterior análisis. Esta técnica es crucial para preconcentrar sustancias traza y determinar la composición elemental. El proceso implica calentar una muestra en presencia de oxígeno, lo que provoca la combustión y oxidación de los compuestos orgánicos, mientras que los residuos inorgánicos permanecen como cenizas. La calcinación se aplica ampliamente en industrias como la alimentaria, petrolera y de pruebas ambientales, y puede regirse por estándares internacionales como ISO, EN o ASTM. Las cenizas resultantes se pueden analizar utilizando técnicas como la cromatografía o la espectroscopia para determinar la composición elemental de la muestra.

Puntos clave explicados:
-
Definición y propósito de la calcinación:
- La calcinación es el proceso de calentar una muestra para eliminar la materia orgánica, dejando atrás cenizas inorgánicas.
- El propósito principal es preconcentrar sustancias traza para análisis químicos u ópticos, como cromatografía o espectroscopia.
- Se utiliza ampliamente en industrias como la alimentaria, petrolera y de pruebas ambientales para determinar la composición elemental.
-
Mecanismo de calcinación:
- La muestra se calienta en presencia de oxígeno, lo que provoca la combustión y oxidación de los compuestos orgánicos.
- Este proceso de oxidación descompone los materiales orgánicos en gases (por ejemplo, CO₂ y H₂O), dejando atrás residuos inorgánicos (cenizas).
- Las cenizas consisten en compuestos no combustibles, como óxidos metálicos, sales y minerales, que pueden analizarse para determinar su composición elemental.
-
Tipos de calcinación:
- Calcinación en seco: Implica calentar la muestra en un horno de mufla a altas temperaturas (típicamente 500–600°C) en presencia de aire. Este método es más lento pero adecuado para muchos tipos de muestras.
- Calcinación en húmedo: Utiliza ácidos fuertes (por ejemplo, ácido nítrico o ácido sulfúrico) para oxidar la materia orgánica a temperaturas más bajas (alrededor de 350°C). Este método es más rápido y a menudo se utiliza para muestras de alimentos.
- Ambos métodos tienen como objetivo lograr la combustión completa de la materia orgánica, pero la elección depende del tipo de muestra y los requisitos de análisis.
-
Aplicaciones de la calcinación:
- Industria alimentaria: Se utiliza para determinar el contenido de cenizas, lo que indica el contenido mineral en los productos alimenticios.
- Industria petrolera: Ayuda a analizar el residuo inorgánico en combustibles y lubricantes.
- Pruebas ambientales: Se utiliza para evaluar el contenido mineral en muestras de suelo, agua y aire.
- Productos farmacéuticos: Garantiza la pureza de las materias primas y los productos terminados mediante el análisis de residuos inorgánicos.
-
Estándares y protocolos:
- Los procesos de calcinación a menudo se rigen por estándares internacionales como ISO, EN o ASTM.
- Estos estándares definen procedimientos específicos, incluidos rangos de temperatura, duraciones de calentamiento y métodos de preparación de muestras.
- Por ejemplo, la pérdida por ignición (LOI) es un protocolo común en el que las muestras se pesan antes y después de la calcinación para determinar la reducción de masa.
-
Ventajas de la calcinación:
- Elimina la materia orgánica no deseada, simplificando el análisis de los componentes inorgánicos.
- Proporciona una muestra concentrada de oligoelementos, mejorando la sensibilidad de las técnicas analíticas posteriores.
- Puede aplicarse a una amplia gama de tipos de muestras, desde sólidos hasta líquidos.
-
Limitaciones y consideraciones:
- Las altas temperaturas en la calcinación en seco pueden causar la volatilización de ciertos elementos, lo que lleva a resultados inexactos.
- La calcinación en húmedo, aunque más rápida, requiere un manejo cuidadoso de ácidos corrosivos y una eliminación adecuada de residuos químicos.
- La elección del método de calcinación debe considerar las propiedades de la muestra y los elementos de interés.
-
Ejemplo práctico: Calcinación en húmedo en el análisis de alimentos:
- Una muestra de alimento se calienta a 350°C en presencia de ácidos hasta que la materia orgánica se oxida por completo.
- Las cenizas restantes se pesan y el contenido de cenizas se calcula en función de la diferencia de peso antes y después del proceso.
- Este método es particularmente útil para determinar el contenido mineral en alimentos como cereales, productos lácteos y bebidas.
Al comprender los principios y aplicaciones de la calcinación, los analistas pueden preparar muestras de manera efectiva para un análisis elemental preciso, asegurando resultados confiables en diversas industrias.
Tabla resumen:
| Aspecto | Detalles |
|---|---|
| Definición | Calentar una muestra para eliminar la materia orgánica, dejando cenizas inorgánicas. |
| Propósito | Preconcentrar sustancias traza para análisis químicos u ópticos. |
| Tipos | Calcinación en seco (500–600°C) y Calcinación en húmedo (350°C con ácidos). |
| Aplicaciones | Alimentos, petróleo, pruebas ambientales, productos farmacéuticos. |
| Estándares | ISO, EN, ASTM (por ejemplo, protocolo de pérdida por ignición). |
| Ventajas | Simplifica el análisis inorgánico, mejora la sensibilidad, aplicación versátil. |
| Limitaciones | Riesgo de volatilización en calcinación en seco; manejo de ácidos en calcinación en húmedo. |
¿Necesita ayuda con las técnicas de calcinación para su laboratorio? ¡Contacte a nuestros expertos hoy mismo para soluciones personalizadas!
Guía Visual
Productos relacionados
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de mufla de 1800℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Qué papel juega un horno mufla de alta temperatura en la medición del contenido de cenizas en muestras de biomasa? Guía de Análisis Preciso
- ¿Cuál es la temperatura de funcionamiento de un horno de mufla? Encuentre su rango ideal para el éxito en el laboratorio
- ¿Cuáles son los usos del horno mufla en la industria farmacéutica? Esencial para la pureza y seguridad de los medicamentos
- ¿Cuál es la temperatura más alta que puede alcanzar un horno? Explorando los límites desde más de 3.000 °C hasta su aplicación
- ¿Cómo se utiliza un horno mufla para la digestión de muestras? Una guía para el calcinado en seco para un análisis preciso



















