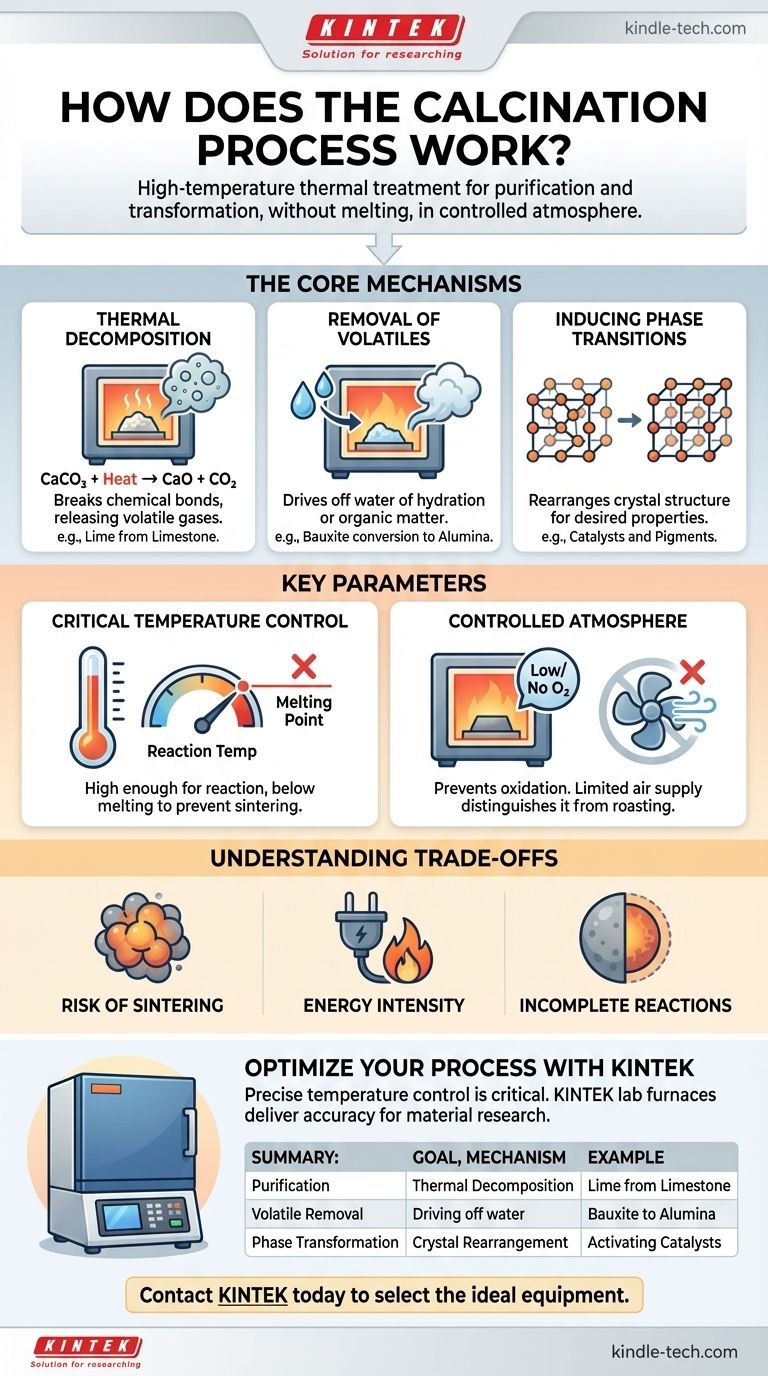
En esencia, la calcinación es un proceso de purificación y transformación impulsado por el calor. Es un tipo específico de tratamiento térmico aplicado a materiales sólidos, donde se calientan a una temperatura alta pero por debajo de su punto de fusión. Esto se realiza en ausencia o con un suministro muy limitado de aire, lo cual es un detalle crítico que lo distingue de otros procesos térmicos. Los objetivos principales son inducir la descomposición térmica, eliminar sustancias volátiles como el agua o el dióxido de carbono, o provocar un cambio en la estructura cristalina del material.
La calcinación no consiste simplemente en calentar un material; es un proceso térmico preciso diseñado para cambiar la composición química o la estructura física de un material sin fundirlo. La clave es controlar la temperatura y la atmósfera para lograr un resultado específico, como la descomposición o la purificación.

Los Mecanismos Centrales de la Calcinación
La calcinación logra sus resultados a través de varios cambios físicos y químicos distintos. El objetivo específico del proceso determina cuál de estos mecanismos es el más importante.
Descomposición Térmica
Este es el objetivo más común de la calcinación. El proceso aplica suficiente energía térmica para romper los enlaces químicos dentro de un compuesto, descomponiéndolo en sustancias más simples.
Un ejemplo industrial clásico es la producción de cal (óxido de calcio) a partir de piedra caliza (carbonato de calcio). Cuando se calienta, el carbonato se descompone, liberando gas dióxido de carbono.
CaCO₃ (sólido) + Calor → CaO (sólido) + CO₂ (gas)
Este óxido de calcio resultante es un componente fundamental en la fabricación de cemento y acero.
Eliminación de Volátiles
Muchos minerales en bruto contienen agua, ya sea absorbida físicamente o químicamente ligada dentro de su estructura cristalina (conocida como agua de hidratación). La calcinación proporciona la energía para expulsar esta agua en forma de vapor.
Por ejemplo, la conversión de bauxita en alúmina para la producción de aluminio implica calcinación para eliminar su agua de hidratación. De manera similar, este proceso se utiliza para eliminar materia orgánica volátil de varios materiales.
Inducción de Transiciones de Fase
A veces, el objetivo no es cambiar la composición química sino alterar las propiedades físicas del material. Calentar un material puede hacer que sus átomos se reorganicen en una estructura cristalina diferente, a menudo más estable o funcionalmente útil.
Esto es común en la producción de catalizadores y pigmentos cerámicos, donde una fase cristalina específica posee la actividad catalítica o el color deseado.
Parámetros Clave que Definen el Proceso
Calcinar un material con éxito requiere un control preciso sobre varias variables. Estos parámetros dictan la eficiencia y el resultado de todo el proceso.
El Papel Crítico de la Temperatura
La temperatura de calcinación debe controlarse cuidadosamente. Debe ser lo suficientemente alta como para suministrar la energía de activación para la reacción deseada (p. ej., descomposición), pero debe permanecer estrictamente por debajo del punto de fusión del material.
Si la temperatura es demasiado baja, la reacción será incompleta. Si es demasiado alta, el material puede fundirse o sinterizarse (fusionarse), lo cual es típicamente un resultado no deseado.
La Atmósfera Controlada
La calcinación se define por su ambiente con bajo contenido de oxígeno o libre de oxígeno. Esto es crucial para prevenir la oxidación, que es una reacción química completamente diferente.
Los procesos que calientan materiales en presencia de abundante aire para causar oxidación deliberadamente se denominan tostación, no calcinación. Esta distinción es fundamental en metalurgia y ciencia de materiales.
Comprender las Compensaciones y Limitaciones
Aunque es potente, la calcinación no está exenta de desafíos. Comprender sus limitaciones es clave para aplicarla eficazmente.
Riesgo de Sinterización
El control deficiente de la temperatura es el riesgo principal. Si la temperatura se acerca demasiado al punto de fusión del material, las partículas individuales pueden comenzar a fusionarse. Este proceso de sinterización reduce el área superficial y puede arruinar las propiedades deseadas del producto final.
Intensidad Energética
Mantener las altas temperaturas requeridas para la calcinación (a menudo 800-1000 °C o más) exige una cantidad significativa de energía. Esto lo convierte en un proceso costoso con una huella ambiental notable, especialmente para reacciones como la producción de cal que liberan grandes volúmenes de CO₂.
Reacciones Incompletas
Lograr una reacción 100% completa puede ser difícil. Si el material no se calienta durante un tiempo suficiente, o si la transferencia de calor es deficiente debido al gran tamaño de las partículas, puede quedar algo del material original sin descomponer, lo que compromete la pureza del producto final.
Tomar la Decisión Correcta para su Objetivo
Los parámetros específicos de su proceso de calcinación dependen enteramente de su producto final deseado.
- Si su enfoque principal es producir un óxido a partir de un carbonato: Debe asegurarse de que la temperatura sea lo suficientemente alta para eliminar todo el CO₂ pero lo suficientemente baja para evitar la sinterización del óxido final.
- Si su enfoque principal es eliminar la humedad: Un perfil de temperatura más bajo puede ser suficiente, centrándose en expulsar el agua sin desencadenar una descomposición química no deseada.
- Si su enfoque principal es lograr una fase cristalina específica: El control preciso de la temperatura y el tiempo de mantenimiento son primordiales, ya que las transiciones de fase ocurren dentro de ventanas de temperatura específicas.
En última instancia, dominar la calcinación reside en entenderla como una herramienta para diseñar con precisión las propiedades finales de un material a través de energía térmica controlada.
Tabla Resumen:
| Objetivo de la Calcinación | Mecanismo Clave | Aplicación de Ejemplo |
|---|---|---|
| Purificación / Descomposición | Descomposición térmica de compuestos (p. ej., carbonatos). | Producción de cal (CaO) a partir de piedra caliza (CaCO₃). |
| Eliminación de Volátiles | Expulsión de agua (hidratación) u otras sustancias volátiles. | Conversión de bauxita en alúmina para la producción de aluminio. |
| Transformación de Fase | Reorganización de la estructura cristalina para alterar las propiedades del material. | Activación de catalizadores o desarrollo de pigmentos cerámicos. |
¿Listo para Optimizar su Proceso de Calcinación?
El control preciso de la temperatura es fundamental para una calcinación exitosa. KINTEK se especializa en hornos de laboratorio de alto rendimiento que ofrecen la precisión y fiabilidad que su laboratorio necesita para la investigación de purificación, descomposición y transformación de materiales.
Contacte a KINTEK hoy para discutir su aplicación específica. Nuestros expertos le ayudarán a seleccionar el equipo ideal para lograr sus objetivos en ciencia de materiales.
Guía Visual
Productos relacionados
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de mufla de 1800℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1700℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuál es la velocidad de rotación de un horno rotatorio? Dominando la velocidad para un control óptimo del proceso
- ¿Cuál es el proceso de pirólisis para fabricar biocarbón? Controlar la temperatura y la materia prima para obtener resultados óptimos
- ¿Cuáles son las desventajas de los incineradores de horno rotatorio? Altos costos y desafíos ambientales
- ¿Cuáles son las distintas regiones dentro del lecho de material durante el modo de movimiento de rodadura? Optimizar la Eficiencia de Mezcla
- ¿Qué combustible se produce mediante el proceso de pirólisis? Descubra un trío de valiosos productos energéticos
- ¿Para qué se utiliza un reactor de lecho fluidizado? Desbloquee una conversión superior de sólido a gas y líquido
- ¿Qué es la técnica de pirólisis? Una guía para la descomposición térmica sin oxígeno
- ¿Qué es la zona de calcinación en el horno rotatorio? La clave para una transformación química eficiente



















