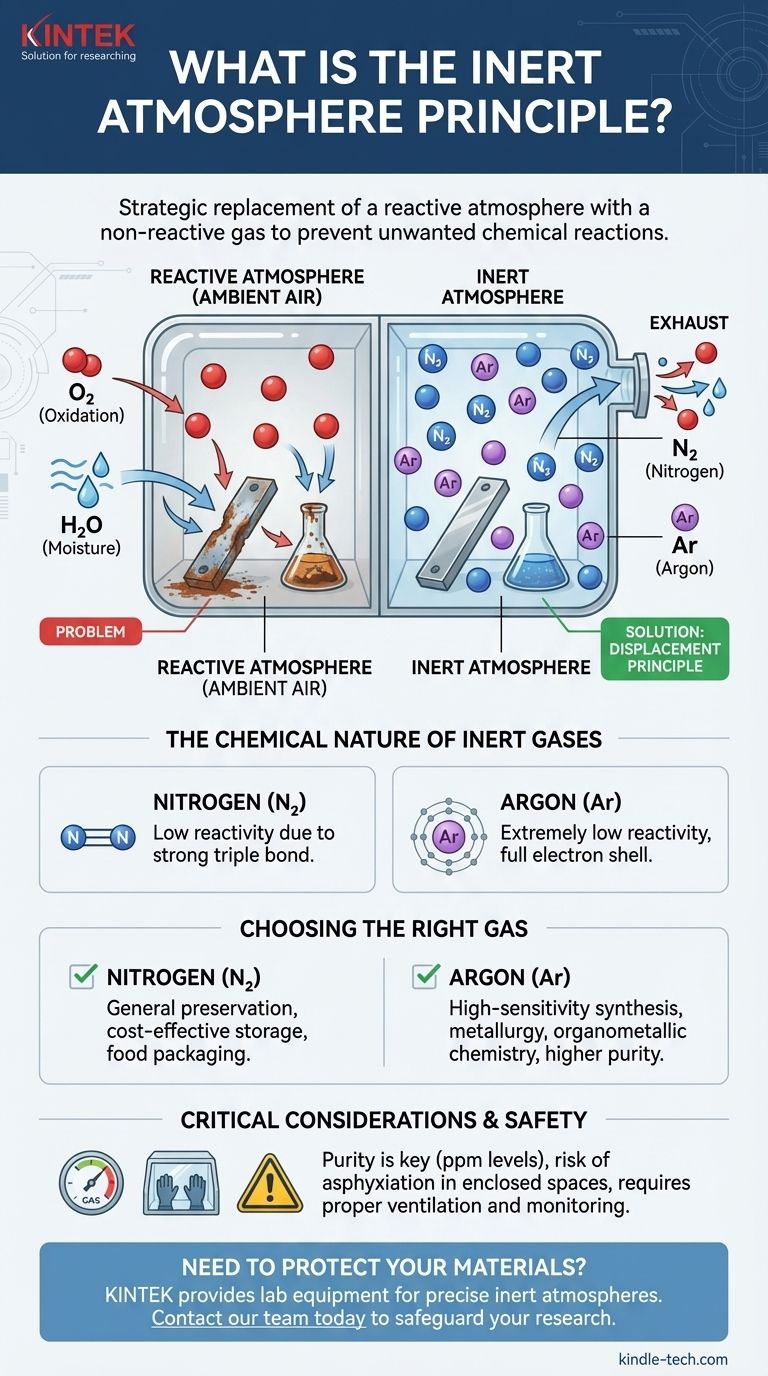
El principio de atmósfera inerte es la sustitución estratégica de una atmósfera reactiva, como el aire ambiente, por un gas no reactivo (inerte). Esto se hace para crear un entorno controlado que previene reacciones químicas no deseadas, como la oxidación y la degradación impulsada por la humedad. Los gases inertes más comunes utilizados para este propósito son el nitrógeno y el argón, que desplazan el oxígeno y el vapor de agua de un sistema.
El objetivo de una atmósfera inerte no es añadir un ingrediente especial, sino eliminar los problemáticos. Al desplazar sistemáticamente gases reactivos como el oxígeno y el agua, se crea un entorno estable que protege los materiales sensibles y asegura que los procesos químicos se desarrollen sin interferencias.

El problema: reactividad atmosférica incontrolada
El aire normal, el entorno en el que existimos, es una mezcla química sorprendentemente reactiva. Para muchos procesos científicos e industriales, esta reactividad es un problema importante.
Por qué el aire normal es un desafío
Nuestra atmósfera se compone de aproximadamente un 21% de oxígeno y cantidades variables de vapor de agua. Ambos componentes son altamente reactivos y están ansiosos por participar en reacciones químicas.
El oxígeno es un potente agente oxidante, lo que significa que acepta fácilmente electrones de otras sustancias. Esta es la causa principal de procesos comunes como la oxidación y la combustión.
El impacto de la oxidación y la degradación
Cuando los materiales sensibles se exponen al aire, pueden degradarse rápidamente. Por ejemplo, el oxígeno puede arruinar un delicado experimento electroquímico al reaccionar en la superficie del electrodo, oscureciendo los resultados que se intentan medir.
De manera similar, muchos productos químicos avanzados, productos farmacéuticos y reactivos se descompondrán o perderán su potencia cuando se expongan al oxígeno o la humedad. Este principio también explica por qué los fabricantes de alimentos envasan productos como las patatas fritas en bolsas llenas de nitrógeno para evitar que los aceites se enrancien.
Cómo una atmósfera inerte resuelve el problema
Una atmósfera inerte contrarresta directamente la amenaza de la reactividad atmosférica cambiando físicamente el entorno a nivel gaseoso.
El principio de desplazamiento
La técnica central implica purgar un recipiente, reactor o cámara con un gas inerte. A medida que el gas inerte fluye, expulsa físicamente, o desplaza, el aire ambiente que contiene oxígeno y vapor de agua.
Esto a menudo se logra burbujeando el gas inerte (como argón o nitrógeno) a través de una solución líquida o purgando continuamente un recinto sellado, como una guantera.
La naturaleza química de los gases inertes
Gases como el nitrógeno (N₂) y el argón (Ar) se eligen porque son extremadamente no reactivos.
El argón es un gas noble, lo que significa que su capa de electrones más externa está completa. No tiene ningún incentivo químico para reaccionar con otros elementos.
El gas nitrógeno es una molécula diatómica (N₂) unida por un enlace triple excepcionalmente fuerte. Se requiere una cantidad significativa de energía para romper este enlace, lo que hace que el gas nitrógeno sea muy estable y poco probable que participe en la mayoría de las reacciones en condiciones normales.
Comprendiendo las compensaciones
Si bien el principio es sencillo, su aplicación práctica implica elecciones importantes y posibles desafíos.
Elegir el gas adecuado: nitrógeno vs. argón
El nitrógeno es el caballo de batalla de las atmósferas inertes. Es mucho menos costoso que el argón y es suficientemente inerte para la gran mayoría de las aplicaciones, desde el envasado de alimentos hasta el almacenamiento químico general.
El argón se utiliza para aplicaciones altamente sensibles donde no se puede tolerar ni la más mínima reactividad. Es químicamente más inerte que el nitrógeno y, al ser más denso que el aire, puede formar una "manta" protectora más estable sobre un proceso. Esto lo hace ideal para la metalurgia a alta temperatura y la síntesis organometálica sensible.
El desafío de la pureza
Simplemente purgar un sistema una vez puede no ser suficiente. Incluso cantidades mínimas de oxígeno o vapor de agua (medidas en partes por millón) pueden ser suficientes para interrumpir experimentos altamente sensibles o degradar materiales ultrapuros.
Lograr y mantener un alto nivel de pureza a menudo requiere una purga continua, un sellado meticuloso del sistema y, a veces, el uso de depuradores de oxígeno para eliminar los últimos rastros residuales.
Consideraciones críticas de seguridad
Los gases inertes son asfixiantes simples. No son tóxicos, pero desplazan el oxígeno necesario para respirar. Trabajar en un espacio cerrado donde se utiliza un gas inerte puede ser extremadamente peligroso y requiere una ventilación adecuada y un monitoreo continuo del oxígeno para prevenir la asfixia.
Tomar la decisión correcta para su objetivo
La selección del enfoque correcto depende completamente de su objetivo, presupuesto y requisitos de sensibilidad.
- Si su enfoque principal es la preservación general o el almacenamiento a granel: El nitrógeno es casi siempre la opción más rentable y práctica para prevenir la oxidación.
- Si su enfoque principal es la síntesis de alta sensibilidad o la electroquímica: El argón es la opción superior por su casi total falta de reactividad, lo que justifica su mayor costo.
- Si su enfoque principal es el procesamiento de metales a alta temperatura: El argón es esencial, ya que el nitrógeno puede reaccionar con algunos metales a altas temperaturas para formar nitruros no deseados.
En última instancia, dominar el principio de atmósfera inerte consiste en controlar el entorno químico para lograr resultados predecibles y fiables.
Tabla resumen:
| Aspecto | Nitrógeno (N₂) | Argón (Ar) |
|---|---|---|
| Uso principal | Preservación general, almacenamiento rentable | Síntesis de alta sensibilidad, procesos a alta temperatura |
| Reactividad | Baja (enlace triple fuerte) | Extremadamente baja (gas noble) |
| Costo | Menor | Mayor |
| Ideal para | Envasado de alimentos, almacenamiento de productos químicos a granel | Metalurgia, química organometálica, electroquímica sensible |
¿Necesita proteger sus materiales o procesos de la oxidación?
En KINTEK, nos especializamos en proporcionar el equipo de laboratorio y los consumibles adecuados para crear y mantener atmósferas inertes precisas para su aplicación específica. Ya sea que requiera una solución de nitrógeno rentable o un entorno de argón ultrapuro para trabajos sensibles, nuestros expertos pueden ayudarlo a seleccionar el sistema óptimo.
Contacte a nuestro equipo hoy para discutir cómo podemos salvaguardar su investigación y producción con soluciones fiables de atmósfera inerte.
Guía Visual
Productos relacionados
- Horno de Atmósfera Controlada de 1200℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuáles son las proporciones típicas de aire a gas para los generadores endotérmicos? Optimización de la configuración de gas natural y propano
- ¿Qué entorno de proceso proporciona un horno de sinterización en atmósfera para LLZ-LGVO? Lograr una unión densificada de alta pureza
- ¿Cuál es la función de un horno de atmósfera en el análisis TG-QMS? Optimice las pruebas precisas de materiales para baterías
- ¿Qué tipo de horno se utiliza en el proceso de recocido? Elija el horno de atmósfera controlada adecuado
- ¿Qué significa atmósfera inerte en la ciencia? Controlar reacciones químicas y garantizar la seguridad del proceso
- ¿Qué es un horno de temple integral? La guía definitiva para el tratamiento térmico en atmósfera sellada
- ¿Por qué se utiliza el nitrógeno en el tratamiento térmico? Para el control dual: protección y endurecimiento superficial
- ¿Qué es una atmósfera exotérmica en un horno? Una guía para la protección rentable de metales



















