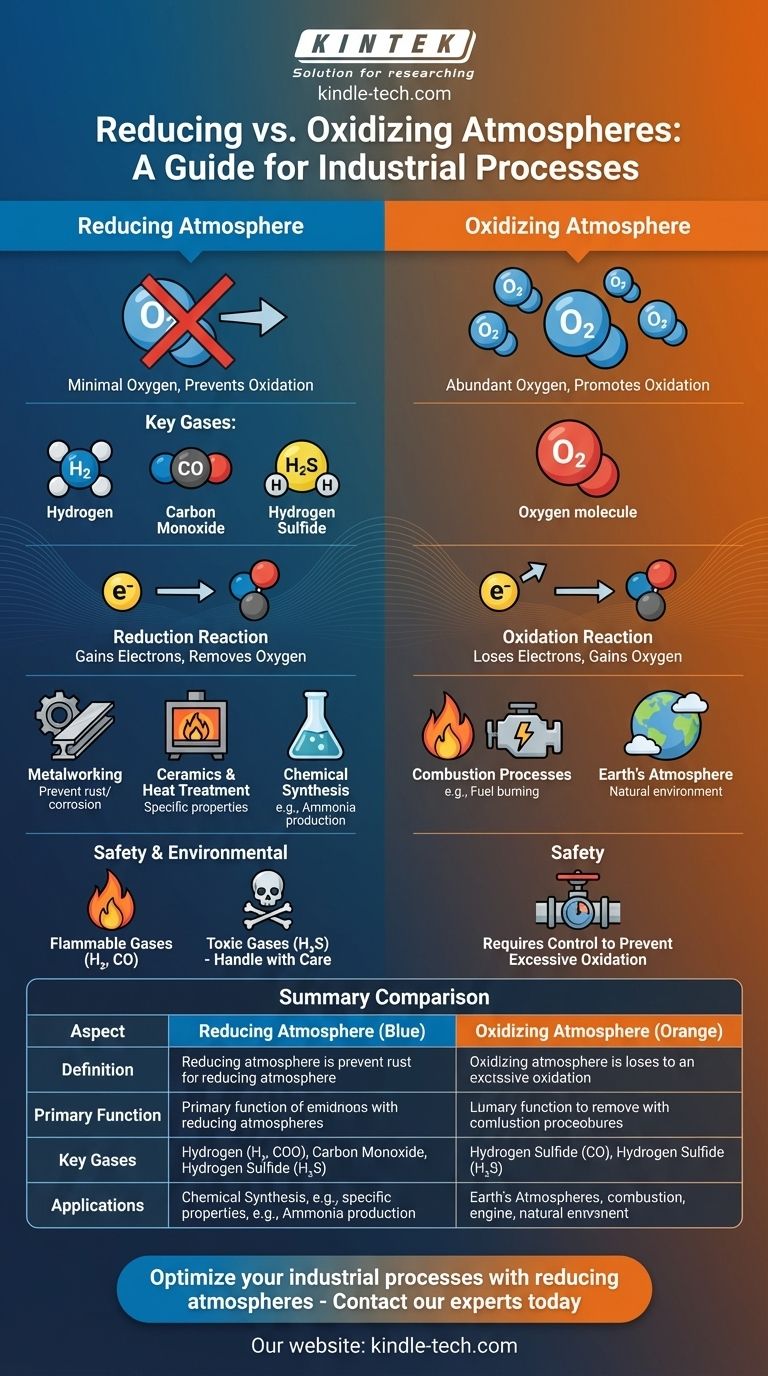
Una atmósfera reductora es un ambiente gaseoso donde la presencia de oxígeno y otros agentes oxidantes se minimiza o elimina, previniendo los procesos de oxidación. En su lugar, contiene gases como hidrógeno, monóxido de carbono y sulfuro de hidrógeno, que promueven las reacciones de reducción. Este tipo de atmósfera se utiliza a menudo en procesos industriales, como la metalurgia y la cerámica, para prevenir la oxidación y lograr propiedades específicas de los materiales. Por el contrario, una atmósfera oxidante contiene abundante oxígeno, lo que facilita las reacciones de oxidación. Comprender la distinción entre estas atmósferas es crucial para aplicaciones en ciencia de materiales, fabricación y estudios ambientales.

Puntos clave explicados:
-
Definición de una atmósfera reductora:
- Una atmósfera reductora se caracteriza por la ausencia o mínima presencia de oxígeno y otros gases oxidantes.
- Contiene gases como hidrógeno (H₂), monóxido de carbono (CO) y sulfuro de hidrógeno (H₂S), que son capaces de donar electrones y promover reacciones de reducción.
- Las reacciones de reducción implican la ganancia de electrones por una sustancia, lo que a menudo lleva a la eliminación de oxígeno de los compuestos.
-
Propósito y aplicaciones:
- Prevención de la oxidación: Se utiliza una atmósfera reductora para prevenir la oxidación, que puede degradar los materiales o alterar sus propiedades. Por ejemplo, en la metalurgia, ayuda a mantener la integridad de los metales al prevenir el óxido o la corrosión.
- Procesos industriales: Es esencial en procesos como el recocido, la sinterización y el tratamiento térmico de metales y cerámicas, donde se requieren atmósferas controladas para lograr características específicas de los materiales.
- Reacciones químicas: En la síntesis química, una atmósfera reductora puede facilitar reacciones que requieren la reducción de compuestos, como la producción de amoníaco (NH₃) a partir de nitrógeno (N₂) e hidrógeno (H₂).
-
Comparación con la atmósfera oxidante:
- Atmósfera oxidante: Este ambiente contiene abundante oxígeno, promoviendo reacciones de oxidación donde las sustancias pierden electrones. Es común en procesos de combustión y ambientes como la atmósfera terrestre.
-
Diferencias clave:
- Las atmósferas reductoras previenen la oxidación, mientras que las atmósferas oxidantes la promueven.
- Las atmósferas reductoras se utilizan en procesos donde la oxidación es indeseable, mientras que las atmósferas oxidantes se utilizan donde la oxidación es necesaria, como en la combustión de combustibles.
-
Ejemplos de gases reductores:
- Hidrógeno (H₂): Un gas altamente reactivo que dona fácilmente electrones, lo que lo convierte en un fuerte agente reductor.
- Monóxido de carbono (CO): A menudo utilizado en entornos industriales para reducir óxidos metálicos a metales puros.
- Sulfuro de hidrógeno (H₂S): Un gas reductor que puede participar en reacciones de reducción, aunque se usa con menos frecuencia debido a su toxicidad.
-
Consideraciones ambientales y de seguridad:
- Manejo de gases reductores: Muchos gases reductores, como el hidrógeno y el monóxido de carbono, son inflamables y requieren un manejo cuidadoso para prevenir explosiones o incendios.
- Toxicidad: Algunos gases reductores, como el sulfuro de hidrógeno, son tóxicos y requieren una ventilación adecuada y protocolos de seguridad.
- Impacto ambiental: El uso de atmósferas reductoras en procesos industriales debe gestionarse para minimizar el daño ambiental, como la liberación de subproductos nocivos.
-
Papel en entornos naturales e industriales:
- Atmósferas reductoras naturales: Raras en la Tierra, pero pueden ocurrir en entornos específicos, como respiraderos hidrotermales de aguas profundas o ciertos hábitats microbianos.
- Atmósferas reductoras industriales: Comúnmente creadas en entornos controlados para procesos de fabricación, como en hornos o reactores, para lograr las propiedades deseadas de los materiales o reacciones químicas.
Al comprender los principios y aplicaciones de las atmósferas reductoras y oxidantes, las industrias pueden optimizar los procesos, mejorar el rendimiento de los materiales y garantizar la seguridad y el cumplimiento ambiental.
Tabla resumen:
| Aspecto | Atmósfera reductora | Atmósfera oxidante |
|---|---|---|
| Definición | Mínimo oxígeno, contiene gases reductores (ej., H₂, CO, H₂S) | Abundante oxígeno, promueve reacciones de oxidación |
| Función principal | Previene la oxidación, promueve reacciones de reducción | Facilita las reacciones de oxidación |
| Aplicaciones | Metalurgia, cerámica, síntesis química, tratamiento térmico | Procesos de combustión, atmósfera terrestre |
| Gases clave | Hidrógeno (H₂), Monóxido de carbono (CO), Sulfuro de hidrógeno (H₂S) | Oxígeno (O₂) |
| Consideraciones de seguridad | Gases inflamables (ej., H₂, CO), gases tóxicos (ej., H₂S) requieren manejo cuidadoso | Menos peligroso pero requiere control para prevenir oxidación excesiva |
Optimice sus procesos industriales con atmósferas reductoras—contacte a nuestros expertos hoy para soluciones personalizadas.
Guía Visual
Productos relacionados
- Horno de Atmósfera Controlada de 1200℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Por qué se usa nitrógeno en los hornos de recocido? Para prevenir la oxidación y la descarburación y obtener una calidad superior del metal
- ¿Qué es una condición inerte? Una guía para prevenir incendios y explosiones
- ¿Cuál es el propósito de una atmósfera inerte? Una guía para proteger sus materiales y procesos
- ¿Por qué se utiliza nitrógeno en los hornos? Un escudo rentable para procesos a alta temperatura
- ¿Se puede calentar el gas nitrógeno? Aproveche el calor inerte para precisión y seguridad



















