El calor requerido para la calcinación no es un valor único y universal. Es una cantidad variable que depende completamente del material específico que se procesa, la reacción química subyacente y la eficiencia del equipo utilizado, como un horno o calcinador. Calcular este valor requiere comprender tanto los principios químicos como las ineficiencias del sistema en el mundo real.
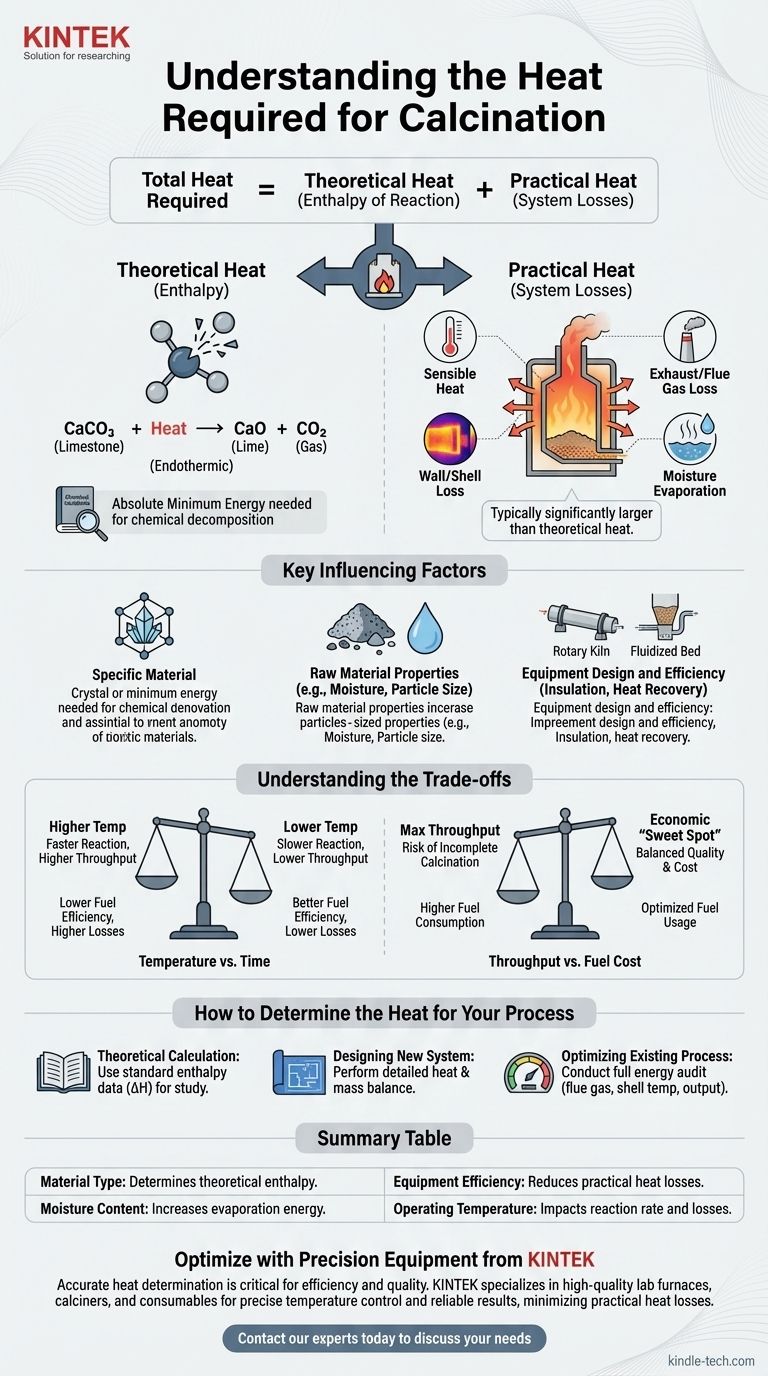
El calor total requerido para cualquier proceso de calcinación es la suma de dos componentes distintos: el calor teórico de reacción necesario para romper los enlaces químicos del material y las pérdidas prácticas de calor inherentes al sistema operativo. Un análisis exitoso debe tener en cuenta ambos.

Los dos componentes del calor de calcinación
Para comprender las demandas energéticas de la calcinación, debemos separar el mínimo teórico de las realidades prácticas de los equipos industriales.
Calor teórico (entalpía de reacción)
Esta es la cantidad mínima absoluta de energía requerida por las leyes de la química para impulsar la reacción de descomposición.
Este valor es fijo para una transformación química dada. Por ejemplo, la calcinación de la piedra caliza (carbonato de calcio, CaCO₃) para producir cal (óxido de calcio, CaO) y dióxido de carbono (CO₂) es una reacción endotérmica, lo que significa que debe absorber una cantidad específica de energía para proceder.
Este requisito de energía teórica se puede calcular o encontrar en manuales de ingeniería química para la mayoría de los materiales comunes.
Calor práctico (pérdidas del sistema)
Esta es toda la energía adicional que debe suministrarse a un sistema del mundo real más allá del mínimo teórico. En la mayoría de las operaciones industriales, este componente es significativamente mayor que el calor teórico de reacción.
Las principales fuentes de pérdida de calor práctica incluyen:
- Calor sensible: Energía utilizada para calentar el material hasta la temperatura de reacción requerida.
- Pérdida por gases de escape/combustión: Calor arrastrado por los gases calientes que salen del calcinador.
- Pérdida por pared/carcasa: Calor que irradia y se convecta desde las superficies exteriores del horno o calcinador.
- Evaporación de humedad: Energía consumida para convertir cualquier agua presente en la materia prima en vapor antes de que la reacción de calcinación pueda siquiera comenzar.
Factores clave que influyen en el requisito de calor
La cifra final de consumo de energía es el resultado de varias variables interactivas. Comprender estos factores es crucial para el diseño y la optimización del proceso.
El material específico
Diferentes materiales tienen enlaces químicos y temperaturas de descomposición muy diferentes. La energía necesaria para eliminar el agua del yeso es mucho menor que la energía necesaria para descomponer el carbonato de calcio.
Propiedades de la materia prima
El estado físico del material importa. Los polvos finos se calientan de manera más uniforme que las rocas grandes, y un alto contenido de humedad inicial puede aumentar drásticamente el consumo de energía debido al alto calor de vaporización del agua.
Diseño y eficiencia del equipo
El tipo de equipo utilizado, como un horno rotatorio, un horno de cuba o un calcinador de lecho fluidizado, tiene un impacto masivo en la transferencia de calor.
Factores como la calidad del aislamiento, la eficacia de los sellos de aire y la presencia de sistemas de recuperación de calor (como precalentadores que utilizan gases de escape calientes para calentar el material entrante) son los principales impulsores de la eficiencia térmica general.
Comprender las compensaciones
Optimizar un proceso de calcinación implica equilibrar objetivos operativos contrapuestos. Ignorar estas compensaciones a menudo conduce a la ineficiencia o a una mala calidad del producto.
Temperatura vs. Tiempo
Temperaturas de funcionamiento más altas pueden acelerar la reacción de calcinación, aumentando el rendimiento. Sin embargo, esto a menudo conduce a una mayor pérdida de calor a través de la carcasa del equipo y los gases de combustión, reduciendo la eficiencia del combustible.
Por el contrario, las temperaturas más bajas conservan energía, pero requieren que el material pase más tiempo en el calcinador, lo que puede limitar la tasa de producción.
Rendimiento vs. Costo del combustible
Impulsar la máxima producción puede conducir a una calcinación incompleta o requerir forzar tanto combustible en el sistema que la eficiencia general se desploma.
Encontrar el "punto óptimo" económico requiere equilibrar cuidadosamente el valor del producto final con el costo del combustible consumido por tonelada.
Cómo determinar el calor para su proceso
No existe una fórmula única, pero puede determinar el requisito de calor centrándose en su objetivo específico.
- Si su enfoque principal es un cálculo teórico para el estudio: Encuentre la entalpía estándar de reacción (ΔH) para su descomposición química específica en una referencia de datos termodinámicos.
- Si su enfoque principal es diseñar un nuevo sistema: Debe realizar un balance detallado de calor y masa que tenga en cuenta las propiedades del material, las especificaciones del equipo y todas las posibles pérdidas de calor.
- Si su enfoque principal es optimizar un proceso existente: Realice una auditoría energética completa de su equipo, midiendo las temperaturas de los gases de combustión, la producción del producto y las temperaturas de la carcasa para identificar y cuantificar las principales fuentes de pérdida de calor.
En última instancia, determinar con precisión el calor de calcinación va más allá de un solo número para convertirse en un análisis exhaustivo de su material y sistema específicos.
Tabla resumen:
| Factor | Impacto en el requisito de calor |
|---|---|
| Tipo de material | Determina la entalpía teórica de reacción (p. ej., piedra caliza vs. yeso). |
| Contenido de humedad | La alta humedad aumenta significativamente la energía necesaria para la evaporación. |
| Eficiencia del equipo | Un mejor aislamiento y los sistemas de recuperación de calor reducen las pérdidas prácticas de calor. |
| Temperatura de funcionamiento | Las temperaturas más altas pueden aumentar la velocidad de reacción, pero también las pérdidas de calor. |
Optimice su proceso de calcinación con equipos de precisión de KINTEK.
Determinar con precisión los requisitos de calor es fundamental para la eficiencia y la calidad del producto. Ya sea que esté diseñando un nuevo sistema u optimizando uno existente, el equipo de laboratorio adecuado es esencial para un análisis térmico y pruebas de materiales precisos.
KINTEK se especializa en hornos de laboratorio, calcinadores y consumibles de alta calidad que proporcionan el control preciso de la temperatura y la fiabilidad necesarios para su investigación y desarrollo de procesos. Nuestras soluciones le ayudan a minimizar las pérdidas prácticas de calor y a lograr resultados óptimos.
Contacte a nuestros expertos hoy para discutir sus necesidades específicas de calcinación y descubra cómo KINTEK puede mejorar las capacidades de su laboratorio.
Guía Visual
Productos relacionados
- Horno de mufla de 1800℃ para laboratorio
- Horno de mufla de 1700℃ para laboratorio
- Horno de Mufla de Laboratorio con Elevación Inferior
- Horno de mufla de 1400 ℃ para laboratorio
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Cuáles son las especificaciones de un horno de mufla? Una guía de características clave y selección
- ¿Cuál es el propósito de un horno mufla? Lograr un calentamiento puro y libre de contaminación a altas temperaturas
- ¿Cuál es una desventaja del calcinado en seco? Evite resultados inexactos con mejores alternativas
- ¿Cuál es el rango de temperatura de un horno? Explicación desde 1100°C hasta más de 2000°C
- ¿Cuál es el rango de temperatura de un horno mufla de laboratorio? Encuentre el modelo adecuado para las necesidades de su laboratorio



















