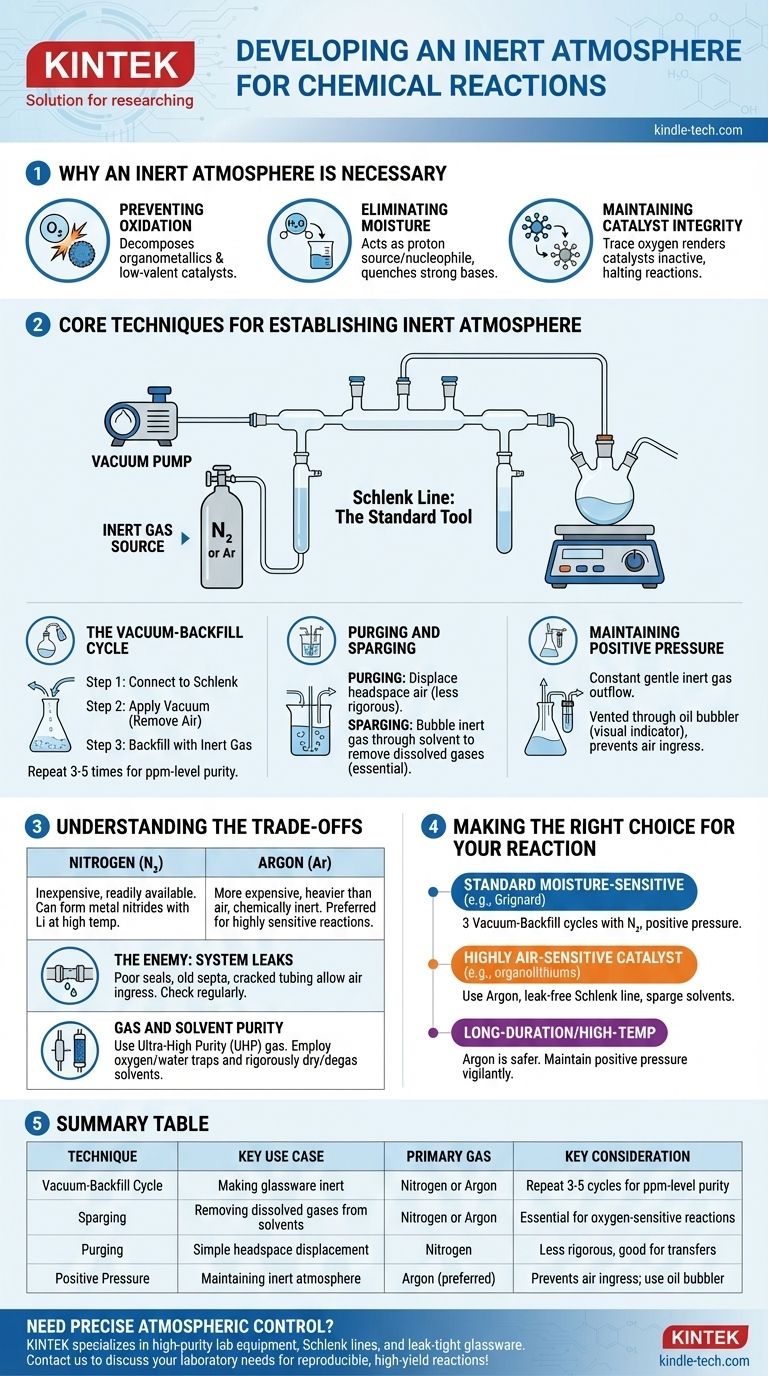
En la práctica, una atmósfera inerte se crea eliminando físicamente el aire reactivo de un recipiente de reacción y reemplazándolo con un gas no reactivo, más comúnmente nitrógeno o argón. Esto se logra típicamente utilizando un sistema de doble colector llamado línea de Schlenk, que permite a un químico alternar entre aplicar vacío al recipiente y rellenarlo con el gas inerte. Este ciclo se repite varias veces para asegurar que todo el oxígeno y la humedad sean eliminados.
El objetivo principal no es simplemente añadir un gas inerte, sino desplazar y eliminar rigurosamente la atmósfera reactiva ya presente. Dominar este control sobre el entorno de reacción es fundamental para prevenir reacciones secundarias no deseadas y asegurar la integridad de los materiales sensibles.

Por qué es necesaria una atmósfera inerte
Muchas reacciones químicas involucran reactivos o producen productos que son sensibles a los componentes del aire ambiente. No controlar la atmósfera puede llevar a reacciones fallidas, bajos rendimientos o la formación de subproductos peligrosos.
Prevención de la oxidación
El culpable más común es el oxígeno molecular (O₂), un potente agente oxidante. Puede reaccionar fácilmente y descomponer muchos reactivos comunes, especialmente organometálicos, catalizadores metálicos de baja valencia e intermedios radicales.
Eliminación de la humedad
El vapor de agua (H₂O) es otra preocupación importante. Actúa como fuente de protones (un ácido débil) y como nucleófilo, lo que puede desactivar bases fuertes (como los reactivos de Grignard u organolitios) o reaccionar con compuestos altamente electrofílicos (como los cloruros de acilo).
Mantenimiento de la integridad del catalizador
En catálisis, el estado activo de un catalizador metálico a menudo se encuentra en un estado de oxidación bajo y específico. La exposición incluso a trazas de oxígeno puede oxidar irreversiblemente el catalizador, volviéndolo inactivo y deteniendo la reacción.
Técnicas fundamentales para establecer una atmósfera inerte
La herramienta estándar para este proceso es una línea de Schlenk, un colector de vidrio conectado tanto a una bomba de vacío como a una fuente de gas inerte de alta pureza. Esta configuración permite dos técnicas principales.
El ciclo de vacío-relleno
Este es el método más común para inertizar la cristalería.
- El matraz de reacción vacío y seco se conecta a la línea de Schlenk.
- Se aplica vacío, eliminando la mayor parte del aire del matraz.
- Se cierra el vacío y se abre la válvula del gas inerte, rellenando el matraz con nitrógeno o argón hasta la presión ambiente.
Este ciclo se repite típicamente de tres a cinco veces para reducir la concentración de oxígeno y humedad a niveles insignificantes (partes por millón).
Purga y burbujeo
La purga implica simplemente pasar un flujo constante de gas inerte a través del espacio de cabeza del matraz para desplazar el aire. Este es un método menos riguroso, pero puede ser útil para transferencias simples.
El burbujeo es el proceso de hacer burbujear el gas inerte a través de un líquido (como un disolvente de reacción) mediante una aguja o tubo largo. Esto es esencial para eliminar los gases disueltos, especialmente el oxígeno, del disolvente antes de que comience la reacción.
Mantenimiento de la presión positiva
Una vez establecida la atmósfera inerte, se mantiene una ligera presión positiva del gas inerte durante todo el experimento. Esto asegura un flujo constante y suave de gas, evitando que el aire se filtre hacia el sistema. Este flujo de salida se ventila típicamente a través de un burbujeador de aceite o mercurio, que también sirve como indicador visual de la velocidad del flujo de gas.
Comprendiendo las compensaciones
Elegir el gas adecuado y ser consciente de las limitaciones del sistema son fundamentales para el éxito. Si bien estas técnicas son potentes, no son infalibles.
Nitrógeno vs. Argón
El nitrógeno (N₂) es el caballo de batalla para la mayoría de la química en atmósfera inerte. Es económico y está fácilmente disponible. Sin embargo, bajo ciertas condiciones (por ejemplo, reacciones con litio metálico a altas temperaturas), puede ser reactivo, formando nitruros metálicos.
El argón (Ar) es significativamente más caro, pero es más pesado que el aire y químicamente inerte en prácticamente todas las condiciones de laboratorio. Es el gas preferido para reacciones altamente sensibles o aquellas que involucran metales que pueden reaccionar con N₂.
El enemigo: las fugas del sistema
La eficacia de su atmósfera inerte es tan buena como el sello más débil de su configuración. Las uniones de vidrio mal engrasadas, los septos de goma viejos o los tubos agrietados pueden permitir que el aire se filtre lentamente de nuevo en el sistema, comprometiendo la reacción. La verificación regular de fugas con un manómetro de vacío es una práctica estándar.
Pureza del gas y del disolvente
Simplemente usar un tanque de gas inerte no es suficiente. Para trabajos extremadamente sensibles, se requiere gas de ultra alta pureza (UHP). Además, se pueden colocar trampas de oxígeno o agua en línea para "depurar" los últimos rastros de contaminantes del gas antes de que entre en el colector. Del mismo modo, los disolventes deben secarse y desgasificarse rigurosamente (a menudo mediante burbujeo) antes de su uso.
Tomando la decisión correcta para su reacción
Su enfoque específico debe adaptarse a la sensibilidad de sus reactivos y al objetivo de su experimento.
- Si su objetivo principal es una reacción estándar sensible a la humedad (por ejemplo, Grignard): Realizar tres ciclos de vacío-relleno con nitrógeno y mantener una presión positiva suele ser suficiente.
- Si su objetivo principal es una reacción que utiliza un catalizador o reactivo altamente sensible al aire (por ejemplo, organolitios, níquel de baja valencia): Usar argón, asegurar una línea de Schlenk sin fugas y burbujear sus disolventes son fundamentales para el éxito.
- Si su objetivo principal es una reacción de larga duración o a alta temperatura: El argón es la opción más segura para evitar posibles reacciones secundarias con el nitrógeno, y debe permanecer vigilante para mantener una presión positiva durante todo el tiempo de reacción.
Dominar estas técnicas de control atmosférico es lo que le da un verdadero dominio sobre el entorno químico, transformando una reacción de una cuestión de azar en un proceso predecible y reproducible.
Tabla resumen:
| Técnica | Caso de uso clave | Gas principal | Consideración clave |
|---|---|---|---|
| Ciclo de vacío-relleno | Inertización de cristalería | Nitrógeno o Argón | Repetir 3-5 ciclos para una pureza a nivel de ppm |
| Burbujeo | Eliminación de gases disueltos de disolventes | Nitrógeno o Argón | Esencial para reacciones sensibles al oxígeno |
| Purga | Simple desplazamiento del espacio de cabeza | Nitrógeno | Menos riguroso, bueno para transferencias |
| Presión Positiva | Mantenimiento de la atmósfera inerte | Argón (preferido) | Evita la entrada de aire; usar burbujeador de aceite |
¿Necesita un control atmosférico preciso para sus reacciones sensibles? KINTEK se especializa en equipos y consumibles de laboratorio de alta pureza, incluyendo líneas de Schlenk, sistemas de purificación de gas y cristalería hermética. Nuestros expertos pueden ayudarle a seleccionar la configuración adecuada para prevenir la oxidación, eliminar la humedad y mantener la integridad del catalizador. ¡Contáctenos hoy para discutir sus necesidades específicas de laboratorio y lograr reacciones reproducibles y de alto rendimiento!
Guía Visual
Productos relacionados
- Horno de Atmósfera Controlada de 1200℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Qué es el tratamiento térmico en atmósfera inerte? Proteja sus metales de la oxidación y la descarburación
- ¿Por qué se usa nitrógeno en los hornos de recocido? Para prevenir la oxidación y la descarburación y obtener una calidad superior del metal
- ¿Cómo se crea una atmósfera inerte? Domine procesos seguros y puros con inertización
- ¿Qué es una condición inerte? Una guía para prevenir incendios y explosiones
- ¿Qué gases se utilizan en atmósferas inertes? Elija el gas adecuado para entornos no reactivos



















