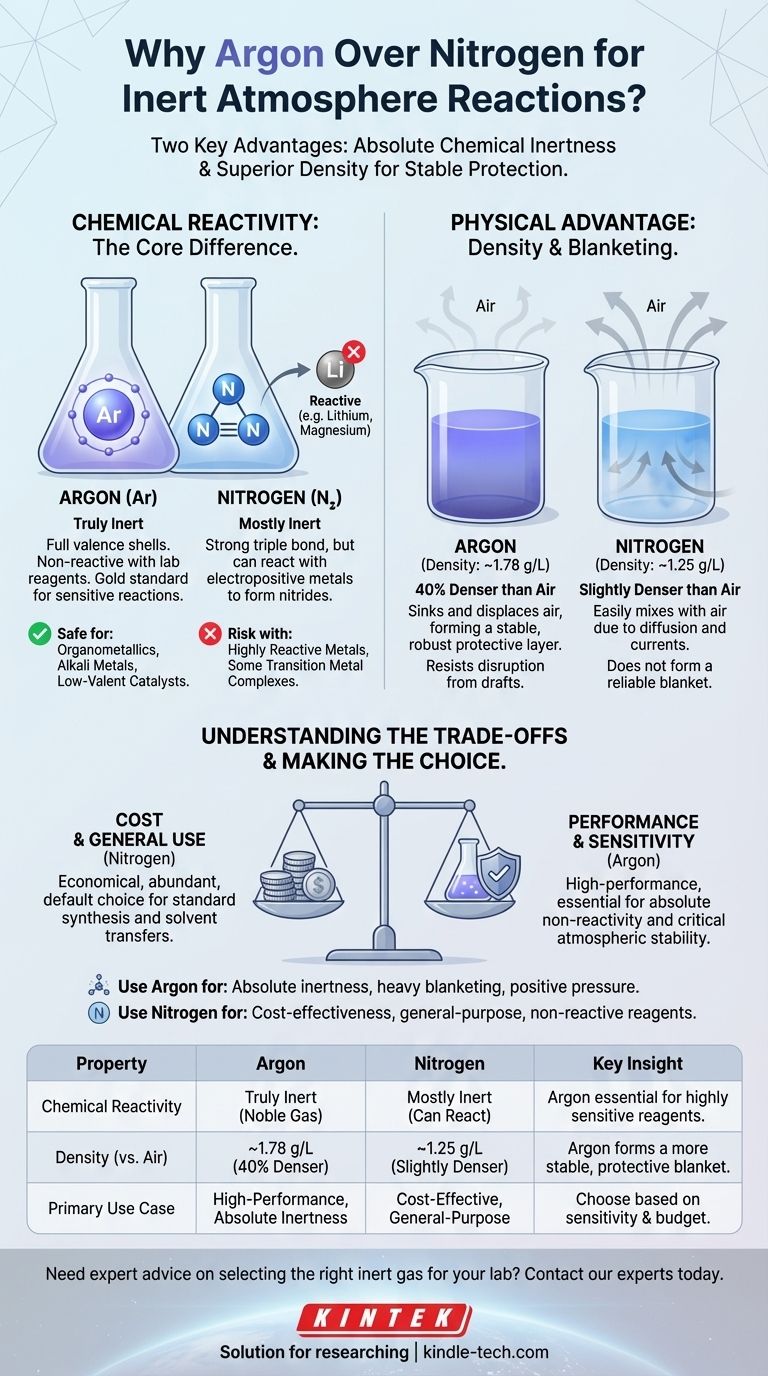
En la práctica, el argón a menudo se considera "mejor" que el nitrógeno para reacciones en atmósfera inerte debido a dos propiedades clave. El argón es un gas noble verdaderamente inerte, incapaz de reaccionar con los reactivos de laboratorio, mientras que el nitrógeno puede reaccionar bajo ciertas condiciones. Además, la mayor densidad del argón le permite formar una "manta" más estable y protectora sobre una reacción, desplazando el aire de manera más efectiva.
La elección entre argón y nitrógeno no se trata de cuál es universalmente mejor, sino de cuál es más apropiado para una tarea específica. El nitrógeno es el caballo de batalla económico para la inertización de uso general, mientras que el argón es la opción de alto rendimiento para reacciones que exigen una no reactividad y estabilidad atmosférica absolutas.

La Diferencia Fundamental: Reactividad Química
La razón más fundamental para elegir un gas sobre el otro se reduce a su potencial para participar en su reacción.
Argón: La Definición de Inerte
El argón es un gas noble. Sus capas de electrones de valencia están completamente llenas, lo que lo hace excepcionalmente estable y no reactivo bajo prácticamente todas las condiciones de laboratorio.
Para un químico, este es el estándar de oro. Puede estar seguro de que el argón no interferirá con su reacción, por muy sensibles que sean los reactivos.
Nitrógeno: "Mayormente" Inerte
El gas nitrógeno (N₂) se compone de dos átomos de nitrógeno unidos por un enlace triple muy fuerte. Este enlace requiere una gran cantidad de energía para romperse, razón por la cual el N₂ es mayormente inerte y sirve bien para muchas aplicaciones.
Sin embargo, no es completamente no reactivo. Los reactivos altamente reactivos, particularmente los metales electropositivos como el litio, el magnesio y algunos complejos de metales de transición, pueden reaccionar con el N₂ para formar nitruros metálicos. Esta reacción secundaria no deseada puede reducir su rendimiento o introducir impurezas.
La Ventaja Física: Densidad
Más allá de la reactividad química, el comportamiento físico del gas en el laboratorio es un factor crítico. El aire es una mezcla de gases, pero tiene una densidad promedio que podemos comparar.
- Densidad del Argón: ~1.78 g/L
- Densidad del Aire: ~1.23 g/L
- Densidad del Nitrógeno: ~1.25 g/L
Cómo la Densidad Crea una "Manta" Protectora
El argón es aproximadamente un 40% más denso que el aire. Cuando purga un matraz con argón, este se hunde eficazmente y desplaza el aire más ligero, empujándolo hacia arriba y hacia afuera. Luego se asienta sobre su mezcla de reacción, formando una manta estable y pesada que resiste la interrupción.
El nitrógeno, en contraste, es solo ligeramente más denso que el aire. Es mucho más susceptible a mezclarse con el aire debido a la difusión y a pequeñas corrientes de aire o corrientes de convección en la habitación. No forma la misma capa protectora robusta.
Implicaciones Prácticas para Montajes de Laboratorio
Esta diferencia de densidad tiene consecuencias en el mundo real. En una guantera o en una línea Schlenk, una presión positiva de argón proporciona una atmósfera más indulgente. Si ocurre una pequeña fuga, el argón denso fluirá preferentemente hacia afuera, evitando que el aire más ligero fluya hacia adentro.
Para técnicas que dependen de cubrir un recipiente abierto, como en muchos experimentos electroquímicos, el argón es muy superior porque permanecerá asentado sobre la solución. El nitrógeno simplemente se mezclaría con el aire circundante casi de inmediato.
Comprendiendo las Ventajas y Desventajas
Elegir el gas ideal requiere equilibrar el rendimiento con las limitaciones prácticas.
Costo: El Factor Decisivo para Muchos
El nitrógeno constituye aproximadamente el 78% de la atmósfera terrestre, mientras que el argón constituye menos del 1%. Esta diferencia en abundancia hace que el nitrógeno sea significativamente más barato de producir y comprar.
Para procesos industriales a gran escala o procedimientos de laboratorio rutinarios donde no se requiere una inercia extrema, el ahorro de costos al usar nitrógeno es sustancial y a menudo lo convierte en la opción predeterminada.
Reactividad: Cuando "Mayormente" Inerte es Suficiente
La reactividad potencial del nitrógeno solo importa si su sistema químico es capaz de romper ese triple enlace N≡N.
Para la gran mayoría de las reacciones orgánicas, purificaciones y transferencias de solventes, el nitrógeno es perfectamente adecuado. Los reactivos simplemente no son lo suficientemente reactivos como para formar nitruros, lo que hace que el argón sea un gasto innecesario.
Tomando la Decisión Correcta para Su Reacción
Base su decisión en las demandas específicas de su procedimiento químico y las realidades prácticas de su laboratorio.
- Si su enfoque principal es la inercia absoluta para reactivos sensibles: Use argón cuando trabaje con organometálicos (especialmente aquellos que involucran Li, Mg), metales alcalinos, catalizadores de metales de transición de baja valencia o cualquier sistema donde la formación de nitruros sea un riesgo conocido.
- Si su enfoque principal es la rentabilidad y el uso general: Use nitrógeno para la mayoría de las síntesis orgánicas estándar, destiladores de solventes, recristalizaciones y otros procedimientos que no involucren especies excepcionalmente reactivas.
- Si su enfoque principal es mantener una atmósfera estable: Use argón para técnicas que requieren una capa pesada de gas, como la electroquímica, o en configuraciones donde mantener una presión positiva contra posibles fugas es crítico.
En última instancia, comprender las propiedades químicas y físicas distintas de cada gas le permite tomar la decisión más informada y económica para su experimento.
Tabla Resumen:
| Propiedad | Argón | Nitrógeno | Conclusión Clave |
|---|---|---|---|
| Reactividad Química | Verdaderamente inerte (gas noble) | Mayormente inerte, pero puede reaccionar con metales electropositivos | El argón es esencial para reactivos altamente sensibles. |
| Densidad (vs. Aire) | ~1.78 g/L (40% más denso) | ~1.25 g/L (ligeramente más denso) | El argón forma una manta protectora más estable. |
| Caso de Uso Principal | Reacciones de alto rendimiento que exigen inercia absoluta | Solución rentable para inertización de uso general | Elija según la sensibilidad de su reacción y su presupuesto. |
¿Necesita asesoramiento experto para seleccionar el gas inerte adecuado para su aplicación de laboratorio específica?
KINTEK se especializa en proporcionar gases y equipos de laboratorio de alta pureza, incluidos sistemas de argón y nitrógeno, para garantizar que sus reacciones sensibles estén perfectamente protegidas. Nuestro equipo puede ayudarle a optimizar su configuración para obtener el máximo rendimiento y seguridad.
Contacte a nuestros expertos hoy para discutir sus necesidades de atmósfera inerte y encontrar la solución más eficiente para su laboratorio.
Guía Visual
Productos relacionados
- Horno de atmósfera controlada de 1400 ℃ con nitrógeno y atmósfera inerte
- Horno de Atmósfera Controlada de 1200℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera Controlada de 1700 ℃ Horno de Atmósfera Inerte de Nitrógeno
- Horno de Atmósfera de Hidrógeno y Nitrógeno Controlado
- Horno de Tubo de Laboratorio de Alta Temperatura de 1400℃ con Tubo de Alúmina
La gente también pregunta
- ¿Qué papel desempeñan los hornos de carbonización y activación en los electrodos de xerogel de carbono activo? Optimice el rendimiento del supercondensador
- ¿Qué es un horno de atmósfera especial? Control preciso para el tratamiento térmico sin oxidación
- ¿Cuál es la función de lo inerte? Prevenir reacciones químicas no deseadas para un proceso controlado
- ¿Cuál es el papel de un horno de sinterización con protección atmosférica en la síntesis de LiFePO4/C? Optimice el rendimiento de la batería
- ¿Por qué es importante la atmósfera controlada? Dominando la preservación y los procesos industriales
- ¿Por qué se requiere un horno de alta temperatura con control de atmósfera para el rGO? Mejore la calidad de su investigación sobre carbono
- ¿Cuáles son las características y usos de una atmósfera preparada a base de nitrógeno? Domine la precisión del tratamiento térmico
- ¿Por qué se introduce aire y vapor de agua durante la preoxidación? Domina la pasivación de superficies para experimentos de coquización



















